
بسم الله الرحمــن الرحيم
جأتكم اليوم بموضوع يتحدث عن الإلكترونيات
أرجوا أن ينال إعجابكم أترككم مع الموضوع
المادة :
تعرف المادة بانها الشئ الذي يشغل حيز من الفراغ ويكون له حجم وكتلة , ذلك الحجم والكتلة يمكن ان يقاسا , ومن امثلة المادة : الهواء , ماء , سيارات , لباس , وحتى اجسامنا …. الخ ) وبهذا يمكن ان نقول بان المادة قد تكون احد هذه الحالات الثلاث : صلبة , غازية , سائلة .
ملاحظات : المادة في الفيزياء الكلاسيكية هي كل ما له كتلة وحجم و يشغل حيزا من الفراغ. و تشكل بذلك ما يعرف بالكون الملموس. يستحيل حاليا تعريف المادة بهذا الشكل لسقوط الفاصل بين المادة و الطاقة طبقا لمعادلة آينشتاين الشهيرة .

الفيزياء الكلاسيكية : هي جزء مهم من الفيزياء ، يطلق عليها اسم كلاسيكية لتمييزها عن الفيزياء الحديثة التي ترتبط بشكل أساسي بمباديء الكم والنسبية ، أما الفيزياء الكلاسيكية فهي تشمل نظريات نيوتن وقوانينه بالاضافة إلى أعمال جاليلو وكوبرنكس وغيرهم ، وتشمل الفيزياء الكلاسيكية فيزياء المقذوفات والطفو .
ورياضيا ، تعتبر المعادلات الفيزيائية الكلاسيكية هي تلك التي لا تحتوي على ثابت بلانك.
العناصر و المركبات :
العنصر مادة لايمكن تحويلها الى مادة ابسط بالطرق الكيميائية .
أمثلة على العناصرِ الحديد ، ذهب، فضة، نحاس، وأوكسجين. هناك الآن أكثر من 100 عنصرِ معروفِ. كُلّ المواد المختلفة المعروفة حولنا تتكون من عنصر أَو أكثر مِنْ هذه العناصرِ.
المركب : مادة تتكون من عنصرين او اكثر مرتبطين كيميائيا معا بنسبة ثابتة, ولايمكنفصلها فيزيائيا (او بالوسائل الطبيعية ) وانما تفصل كيميائيا .
امثلة على المركبات المترابطة كيميائيا: الماءَ الذي يشمل الهيدروجينِ والأوكسجينِ، وملح الطعام ، الذي يَشْملُ الصوديومِ والكلورِ.
وهناك مجموعة من العناصر التي لاتكون مرتبطة كيميائيا ويمكن ان تفصل بالوسائل الطبيعية مثل الهواء الجوي الذي يتكون من النتروجينِ، أوكسجين، ثاني أكسيد الكاربون، وكميات صغيرة لعِدّة غازات نادرة، وماء البحر، الذي يتكون بصورة رئيسية مِنْ الملحِ والماءِ.
الجزيئات :
الجزئ : هو اصغر جسيم للعنصر او المركب يحتفظ بخواص العنصر او المركب , ويتكون من ذرتين او اكثر ويرتبط برابطة كيميائية .
ولنعتبر الماء H2o على سبيل المثال , يعتبر الماء مادة على اساس انه يشغل حيز من الفراغ وله حجم .
وقد يتحول من حالة الى حالة وذلك يتوقف على درجة الحرارة ممكن ان يكون صلب( ثلج) او سائل(ماء) او غاز(بخار) وبغض النظر عن درجة الحرارة , فسوف يكون له نفس التركيب , ولو قمنا بتقسيم الماء في كل مرة الى قسم سوف نصل في النهاية الى قسم لايمكن تجزيئه , وهذه الكمية الباقية تسمى جزيءة الماء واذا قمنا بتقسيم هذه الجزيئة سوف نحصل على جزئ من الاكسجين O وجزيئان من الهيدروجين H2.
الذرات:
الجزيئات تتكون من جزيئات اصغر تسمى الذرات , الذرة الجزيئة الاصغر للعنصر التى تحتفظ بخصائص العنصر , وعلى اية حال ذرات العنصر الواحد تختلف عن ذرات بقية العناصر الاخرى , وحيث ان العناصر اكثر من 100 عنصر فلابد ان يكون هناك اكثر من 100 ذرة مختلفة , مثل حروف الهجاء يمكن ان تكون منها الالاف الكلمات بربط الاحرف , كذا بالنسبة للمواد يمكن ان تكون الالاف المواد بارتباط الذرات بعضا مع بعض كيميائيا .
الجزيئة تتكون من ذرتين او اكثر , جزيئة الاكسجين تشمل ذرتين من الاكسجين وكذلك جزيئة الهيدروجين تشمل ذرتين من الهيدروجين , ومن ناحية اخرى فمثلا السكر مكون من ذرات الكربون والهيدروجين والاكسجين وهذه الذرات متحدة مع بعضها مكونة جزيئة السكر , وحيث انه يمكننا تحطيم جزيئات السكر بالوسائل الكيميائية ومع ذلك لايمكننا الحصول على ذرات للسكر .
ان ذرات كل عنصر تتكون من الالكترونات والبروتونات , وفي الغالب يتكون من النيوترونات , وتتشلبه الالكترونات والبروتونات والنيترونات في كل العناصر , والذي يميز عنصر الى اخر هو اختلاف عدد وترتيب الالكترونات والنيترونات والبروتونات في الذرة .
الالكترون له شحن سالبة , والبروتون ل شحنه موجبة بينما النيترون فهو متعادل(لاشحنه له).
قاس العلماء كتلة وحجم كل من البروتون والالكترون وكلاهما له نفس كمية الشحنه بالرغم من ان كتلة البروتون تقريبا اكبر 1837 مرة من الالكترون , وفي بعض الذرات يوجد النيترون وهو متعادل الشحنه , وله نفس كتلة البروتون.
ويشابه ترتيب الالكترونات والبروتونات والنيترونات في الذرة كنظام شمسي صغير , والنواة تتشكل من البروتونات والنيترونات لها شحنه موجبة تدور حولها الالكترونات .
في الشكل 1-1 نشاهد ذرة هيدروجين وذرة هيليوم . كل له تركيب بسيط نسبيا , ذرة الهيدروجين لها فقط بروتون واحد في النواة ويدور حوله الالكترون بينما ذرة الهليوم مكونه من بروتونين ونيوترون , ويدور حولها الكترونين , العناصر تصنف بشكل عدد طبقا للتعقيد في ذراتهم .
ان العدد الذري لذرة محدد بعدد البروتونات في نواتها .
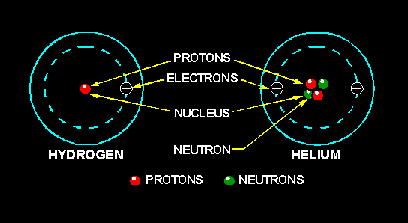
الشكل 1-1
في الحاله الطبيعيه تحتوي الذره على عدد متساوي من البروتونات والالكترونات , لذا ذرة الهيدروجين التى تحتوي على بروتون واحد والكترون واحد لها عدد ذري 1 والهيليوم يحتوي على بروتونين والكترونين له عدد ذري 2 , ويزداد العدد الذري بزيادة عدد البروتونات والالكترونات .
مستويات الطاقة :
الالكترون في الذرة له كتلة وله حركة , ويحتوى على نوعان من الطاقة .
استنادا الى حركته فلدية طاقة حركية , وبالنسبه لموقعه فلديه طاقة وضع . فتكون الطاقة الكلية له عبارة عن (طاقة الوضع + طاقة الحركة ) وهي العامل الذي نحدد منه نصف قطر مدار الالكترون , ولكي يبقى الالكترون في مداره فيجب ان لايفقد او يكسب طاقه .
من المعلوم ان الضوء هو عبارة عن نوع من انواع الطاقة , ولكن الشكل الطبيعي لهذه الطاقة غير معروف .
وتوجد نظرية مقبولة تقول ان الضوء موجود كرزم صغيرة من الطاقة تدعى الفوتونات , والفوتونات يمكن ان تحتوى على كميات مختلفة من الطاقة وتعتمد كمية تلك الطاقة على لون الضوء , عندما يصطدم الفوتون الذي يحتوى على طاقة كافية في الالكترون الذي في المدار سوف يمتص الالكترون طاقة الفوتون كما في الشكل 1-2
وبذلك تكون طاقة الالكترون اكبر من الطاقة الطبيعية لذا فانه يقفز الى مدار جديد يكون ابعد عن النواة وهذا المدار الجديد يكون نصف قطره اكبر اربع مرات من نصف قطر المدار الاصلي واذا استلم الالكترون طاقة اكبر فان المدار المحتمل ان يقفز له الالكترون يكون نصف قطره اكبر تسع مرات من القطر الاصلي وهكذا .. وكل مدار قد يعبر عن كمية من الطاقة التي يحصل عليها الالكترون لكي يقفز لذلك المدار .
ومن المؤكد ان الالكترون لايستطيع القفز الى أي مدار حتى يحصل على الطاقة الكافية ولايمكن ان يوجد الالكترون بين مستويين من مستويات الطاقة (بين مدارين) ونعرف من ذلك ان الالكترون لن يستقبل الفوتون الذي لايحمل الطاقة الكافية لنقله الى مستوى اخر.
الطاقة الحرارية والاصطدامات بين الجزيئات قد تؤدي الى قفز الالكترون من مستوى الى آخر .

الشكل 1-2
عندما ينتقل الالكترون الى مستوى طاقة اعلى , تكون الذرة في حالة متحمسة (مثارة) , الالكترون لن يبقى في هذا الشرط المتحمس لاكثر من جزء من الثانية قبل ان يشع الطاقة الفائضه ويعود الى مدار الطاقه الاقل .
ولتصور هذا الشئ :
نفترض بان الكترون ما استلم فوتون فيه طاقة تكفي لرفعه من المستوى الاول الى المستوى الثالث من مستويات الطاقة , وفي فترة زمنية قصيرة قد يعود الالكترون الى المستوى الاول ويبعث فوتون جديد مماثل للذي تم استلامه .
ويمكن ايضا للالكترون ان يعود الى المستوى الاول في قفزتين , وتكون قفزة من المستوى الثالث الى الثاني , ومن الثاني الى الاول وفي هذه الحالة الالكترون يبعث فوتونات , واحد لكل قفزة وهذه الفوتونات المنبعثة ستكون طاقتها اقل من الطاقة للفوتون الاصلي الذي استلم الالكترون في البداية .
هذا المبدأ مستخدم في الضوء المشع حيث انها فوتونات الاشعة فوق بنفسجية , وهي غير مرئية بالعين المجردة , عندما نقوم بطلاء انبوب زجاجي بمادة الفوسفور , تعود الكترونات الفوسفور الى مدارها الاصلي وتبعث فوتونات مرئية بالعين , وباستخدام المواد الكيميائية المناسبة لطلاء الفوسفور نحصل على أي لون للضوء ومنها الابيض . ونفس هذا المبدأ مستخدم في اضاءة انبوبة شاشة التلفزيون.
المبادئ الاساسية المطورة يمكن استخدامها في ذرات العناصر الاكثر تعقيدا , في الذرات التى تحتوى على الكترونين او اكثر , تتفاعل الالكترونات مع بعضها البعض , والموقع الدقيق للالكترون الواحد صعب التوقع .
على اية حال كل الكترون يقع في نطاق طاقة معين والمدارات ستعتبر معدل الموقع للالكترونات .
وعليكم السلام ورحمة الله وبركاته
بسم الله الرحمن الرحيم
الحمدلله والصلاة والسلام على رسول الله وعلى آله وصحبه أجمعين
موفق بإذن الله … لك مني أجمل تحية .
كيف حالك إن شاء الله دائما بخير ؟
ألف مبروك .. لقد سعدت بهذا الخبر
ههههههههههههههههههههههههه