التصنيف: البيولوجيا Biologie
البيولوجيا Biologie
1. Les enzymes sont des protéines.
2. Sur une enzyme, le site de fixation du substrat représente une petite zone de l’enzyme et est formé par des acides aminés éloignés sur la structure primaire de l’enzyme.
3. Le site de fixation du substrat est responsable de la spécificité de l’enzyme.
4. La spécificité des enzymes permet aux enzymes de différencier des énantiomères.
5. Une enzyme qui a une specificité large reconnaît de nombreux substrats.
6. Les acides aminés qui ne composent pas les sites catalytique et de liaison sont responsable de la bonne conformation des sites de l’enzyme.
7. Le site de fixation contient des acides aminés capables de reconnaître le substrat et il est complémentaire du substrat.
8. Le site catalytique est différent du site de fixation.
9. L’ajustement induit indique la capacité des enzymes a modifier leur conformation pour s’adapter au substrat.
10. Les isozymes sont des enzymes différentes mais catalysant des réactions identiques.
11. Les proenzymes sont activées seulement par leur dégradation.
12. Les proenzymes sont utiles pour protéger les cellules productrices de ces enzymes et obtenir une forte activité en très peu de temps.
La cinétique enzymatique
13. La cinétique enzymatique concerne l’étude de la vitesse de la réaction chimique catalysée.
14. Les étapes de la catalyse sont au nombre de 2 : association Enzyme substrat et catalyse.
15. Le facteur limitant d’une réaction enzymatique est la constante catalytique (kcat).
16. En règle générale, la constante catalytique est bien plus petite que la constante de dissociation du complexe Enzyme-substrat.
17. Les conditions initiales nécessaires à l’étude cinétique, concerne la concentration de substrat et la concentration de produit.
18. La vitesse d’une réaction dépend directement de la concentration en complexe enzyme-substrat.
19. La vitesse initiale d’une réaction dépend de la concentration en substrat, de la concentration en enzyme et de la température.
20. La vitesse initiale d’une réaction se détermine sur un graphique concentration de produit formé en fonction du temps.
21. La vitesse initiale d’une réaction se détermine sur un graphique grâce à :
– la tangente de la courbe après 2 minutes exactement.
– la tangente de la courbe au temps 0.
– la tangente de la courbe au moment ou la réaction est totale.
22. La vitesse d’une réaction enzymatique à l’équilibre est Nulle.
23. L’augmentation de la concentration en substrat augmente la vitesse initiale de la réaction.
24. L’augmentation de la concentration en substrat ne produit aucun effet sur la vitesse initiale si la concentration est saturante au départ.
25. La vitesse initiale n’est pas toujours proportionnelle à la concentration en enzyme car il arrive un moment où les conditions initiales ne sont plus respectées.
26. La vitesse initiale est maximale lorsque le pH est acide, neutre ou basique.
27. La vitesse maximale est atteinte par une enzyme lorsque la concentration en substrat est élevée.
28. L’équation de Michaelis-Menten permet de calculer la vitesse initiale d’une réaction si vous connaissez la concentration en substrat.
29. La constante de Michaelis-Menten est la concentration en substrat nécessaire à l’enzyme pour atteindre la moitié vitesse maximale.
30. Les constantes enzymatiques (Vmax et KM) sont déterminées expérimentalement sur un graphique 1/Vi = f (1/)
31. Un inhibiteur compétitif modifie le KM.
32. Un inhibiteur non compétitif modifie le Vmax.
33. Un inhibiteur compétitif se lie au site de reconnaissance de l’enzyme et il possède une structure comparable au substrat.
34. Un inhibiteur non compétitif se lie sur un site différent du site de reconnaissance de l’enzyme.
[/COLOR]
réaliser des réactions d’agglutinations avec des sangs de groupe connu,
pour cela vous disposez d’un tube de sang, de flacons de sérum-test et de flacons de globules-test.
En cliquant sur les flacons une goutte de sérum, de globules ou de sang est déposée dans les cavités de la plaque à réactions. Chaque cavité correspond à un produit test, le sang à tester étant réparti dans toutes les cavités.
Remarque : l’image ci-dessous représente une
agglutination.

M-M LEPAGE & R MONTANARI
[web]http://c.coupin.free.fr/cartable/troisieme/protection%20_organisme/gpesang/menu.htm[/web]
Intro:
La toxicité du mercure est connue depuis l’Antiquité. Elle est déjà évoquée par Pline l’Ancien au 1er siècle de notre ère. A cette époque, les Romains exploitaient les mines de Cinabre (minerai dont on tire le Mercure) d’Almaden en Espagne, pour la confection de pigments et de produits cosmétiques. Mais l’atmosphère était si délétère que les mineurs résistaient à peine 2 ou 3 ans.
En raison de ses multiples utilisations le mercure a été à l’origine de nombreuses intoxications aiguës, subaiguës ou chroniques. L’expression « travailler du chapeau » illustrait la folie des chapeliers qui utilisaient le mercure (nitrate mercurique) dans le procédé de secrétage qui permettait de feutrer les peaux. D’où le “mad hatter” (chapelier fou) d’Alice au pays des merveilles.
La catastrophe sanitaire de Minamata au Japon dans les années 50 a fait découvrir au monde entier la redoutable toxicité du mercure, notamment pour le fœtus. Les villageois s’intoxiquaient en consommant des poissons contaminés par du méthylmercure, dont l’origine était une pollution industrielle. Plusieurs intoxications collectives résultant de la consommation de semences traitées avec des organomercuriels ont eu lieu dans la 2ème moitié du 20ème siècle, comme en Irak dans les années 70. Et bien sûr, l’utilisation de mercure dans de nombreux médicaments a été à l’origine de nombreuses maladies iatrogènes. Le calomel (chlorure mercureux), utilisé dans le traitement de la syphilis et de la fièvre puerpérale, a abrégé bien des souffrances. De ces utilisations, il reste surtout celle de l’éthylmercure (thiomersal) dans certains vaccins (vaccins antigrippaux) et du mercure métallique dans les amalgames dentaires.
L’intoxication au mercure s’appelle l’hydrargyrisme. Elle recouvre des troubles et maladies neurologiques et est inscrite en France au tableau des maladies professionnelles depuis 1919.
Mode d’action du mercure sur la cellule
– L’activité cytotoxique du mercure est liée à sa grande affinité pour le soufre, entraînant le blocage des fonctions thiol (-S-H) des protéines (modifiant ainsi leur structure tertiaire et quaternaire), des peptides (glutathion) ou des acides aminés soufrés (cystéine). Les protéines ainsi inactivées peuvent être des enzymes, des protéines des membranes cellulaires (notamment des récepteurs d’hormones et de neuromédiateurs), des protéines membranaires des organites cellulaires (mitochondries, lysosomes…), des protéines membranaires impliquées dans les transports ioniques (ATPase Na-K, canaux calciques) ou encore la tubuline et la myéline, ce qui provoque de graves perturbations dans la conduction de l’influx nerveux.

4émeّ année
Modules VHG Cours TP/TD Coeff.
—————————————————————————————
1. Aspects moléculaire et cellulaire 75 45 30 4
du développement
2. Neurobiologie moléculaire & 60 30 30 3
fonctionnelle
3. Immunologie moléculaire et cellulaire 75 45 30 4
4. Biochimie appliquée 75 45 30 4
5. Anglais scientifique 45 30 15 1
6. Initiation à la recher. Bibliographique (Séminaire 2 ou 3 séances)
—————————————————————————————-
Total 330
NB.: Les volumes horaires des modules de 4° année (S7) sont comme indiqués sur le tableau ci-dessus.
ASPECTS MOLECULAIRE ET CELLULAIRE DU DEVELOPPEMENT
VHG 78
Cours 45
TP/TD 30
Coeff. 4
I. Rappel des grandes étapes d’embryologie “classique”
II. Les premières cellules de développement
1. Les cellules germinales et les synthèses moléculaires
2. La fécondation : activation et synthèses moléculaires
3. Exemple d’étude de la variabilité dans la nature et la synthèse d’une protéine au cours des différents stades de développement : exemple de la LDH chez la souris
III. Les mouvements morphogéniques dans l’organisatioon spatiale de l’embryon
1. Les polarites
2. La segmentation
3. La gastrulation
4. Evolution des feuillets germinaux
IV. La diversification et la mémoire cellulaire :
1. Variation du mode d’expression des genes au cours du développement
2. Interactions chimiques entre les blastomères
3. Interactions intercellulaires dans la différenciation des cellules embryonnaires
4. La détermination cellulaire
V. L’organogénèse
1. Plan d’organisation
2. Les molécules d’adhérence dans les déplacements morphogéniques
3. L’information de position (mésoderme)
VI. Etude de quelques gènes de développement (cas des drosophiles)
1. Les chromogènes – exemple mutation sur le gène Lin14
2. Les gènes à effets maternels (principalement gènes impliqués dans polarité de l’embryon)
– mutation bicoïd
– mutation oscar
– mutation dicéphalique
3. Les gènes zygotiques de segmentation
– gènes de type Pair-rule
– gènes de type Fushi-tarazu
– gènes de type Even-skipped
– gènes de type Engrailed
4. Les gènes homéotiques : définition de la nature de chaque segment
– complexe Antennapedia (Ant-C)
– complexe Bithorax (BX-C)
– les Homéobox
NEUROBIOLOGIE MOLECULAIRE ET FONCTIONNELLE
VHG 60
Cours 30
TP/TD 30
Coeff. 3
I. Notions générales sur le système nerveux
1. Cytologie du neurone et des éléments cellulaires associés
2. Histologie et anatomie du système nerveux
3. Embryologie et développement
4. Culture in-vitro des neurones et des cellules associées
II. Chimie du système nerveux
1. les constituants chimiques du système nerveux
2. les transmetteurs chimiques
– le système cholinergique
– le système cathécol-indolaminergique
– autres systèmes de neurotransmission
3. pharmacologie moléculaire et cellulaire des neurotransmeteurs
III. Electrophysiologie du système nerveux
1. Electrophysiologie du neurone
2. Elctrophysiologie des structures cérébrales
IV. Bases moléculaires des comportements
1. Apprentissage et mémoires
2. Sommeil et vigilance
3. Agressivité
4. Douleur
5. Soif, faim et thermogénèse
6. Autres comportements
IMMUNOLOGIE MOLECULAIRE ET CELLULAIRE
VHG 75
Cours 45
TD/TO 30
Coeff. 4
1. RAPPELS SUR LA REPONSE IMMUNITAIRE
1. Moëlle osseuse
2. Thymus
3. Ganglions lymphatiques
4. Tissus lympho‹des associés aux Muqueuses (TLAM)
5. La nate
6. Cellules présentants l’antigène (CPA et autres)
2. ACTIVATION DES LYMPHOCYTES (T et B)
3. SYNTHESE DES ANTICORPS ET LEUR DIVERSITE
4. IMMUNITE CELLULAIRE
1. Lymphocytes T auxilliaires et production de lymphokines
2. Lymphocytes T cytotoxiques
3. Récepteurs des lymphocytes T
4. Phénomène de la cytotoxicité
5. ACQUISITION DE LA MEMOIRE
6. LA SPECIALITE DE L’IMMUNITE ACQUISE
7. LA VACCINATION
8. LES HYBRIDOMES ET ANTICORPS MONOCLONAUX
9. CONTROLE DE LA REPONSE IMMUNITAIRE
10. DEVELOPPEMENT DU SYSTEME IMMUNITAIRE
11. IMMUNITE ANTI-INFECTIEUSE
12. IMMUNOPATHOLOGIE
1. Les maladies auto-immunes
2. Les états d’hypersensibilité (HS)
2.1. les différents types d’HS (I,II,III,IV)
2.2. l’HS médicamenteuse
3. Les déficits immunitaires
13. LES RELATIONS FONCTIONNELLES ENTRE SI ET SYSTEME
NEUROENDOCRINIEN
14. ASPECTS MOLECULAIRE DE LA TRANSPLANTATION ET
REJET DES GREFFES
BIOCHIMIE APPLIQUEE
VHG: 75
Cours 45
TP/TD 30
Coeff. 4
Préambule : L’objectif assigné à ce module est d’aborder certains aspects pratiques des enseignements dispensés en 2éme et 3éme année en égard à la compléxité des structures et des phénomènes se trouvant dans la nature et de l’utilisation des substances biologiques dans les domaines variés : agriculture, environnement, alimentation, santé, industrie (cosmétique, tannerie, etc….)
De part les chapitres qui le constituent, ce module peut être dispensé sous forme de conférences par plusieurs intervenants, chacun se proposant de traiter un domaine de spécialité bien défini. Il est aussi recommandé d’illustrer les volets pratiques soit par le montage de TP appropriés, soit par la visite d’unités de production ou de transformation.
Enfin, plusieurs thèmes relatifs au contenu de ce module peuvent être traités par les étudiants sous forme d’exposés.
Chap. I : Biochimie des substances d’origine végétales :
1. les macromolécules de la paroi végétale
(proteines, cellulose, Hémicellulose, pectines, lignines et autres substances)
2. les substances foliaires
(protéines foliaires, obtention d’isolats et de concentrats)
3. métabolites secondaires
(les alcaloïdes, terpènes, polyphénols)
A développer :
– origine et localisation
– composition , structure
– isolement et extraction
– intérêts
Chap. II : Biochimie des substances d’origine animale
1. Constituants des liquides biologiques
1.1. sang
1.2. sérum du lait
A développer :
– composition, structure des constituants
– Isolement et valorisation
2. Culture de cellules animales (eucaryotes)
2.1. le cycle cellulaire et les moyens d’études
2.2. les différents types de culture (organotypiques, culture de cellules isolées).
2.3. L’hybridation cellulaire – application à la production d’anticorps monoclonaux
Chap. III : Biochimie de substances d’origine microbienne
1. Les enzymes
2. Les vitamines
3. Les antibiotiques
4. Culture de biomasse et production d’organismes unicellulaires (P.O.U.)
(synthèse d’acides aminées, d’acides organiques, de vitamines,…)
Chap. IV : Enzymologie appliquée
1. Les enzymes immobilisés et leur intérêt
1.1. méthodes d’immobilisation des enzymes
1.2. propriétés des enzymes immobilisées
1.3. applications
1.4. réacteurs enzymatiques
2. Les enzymes artificielles
Cas des cyclodentrines: intérêt dans l’utilisation en industrie agro-alimentaire.
Les antigenes.
Un antigène est un élément étranger à un organisme qui entraîne chez celui-ci, une réaction immunitaire. Il existe deux grandes familles d’Ag :
– Les xéno-antigènes : ce sont des Ag dont l’espèce est différente de celle de l’organisme attaqué.
– Les allo-antigènes : ce sont des Ag qui font parti d’une même espèce (cas des greffes).
I La notion d’épitope.
Définition : c’est la partie d’un Ag qui est reconnue par un Ac. Elle est souvent petite (entre 12 et 18 AA).
Certains épitopes sont plus reconnus que d’autres : on parle alors d’épitopes immuno-dominants (en général, ce sont les parties protéiques qui sont à l’extérieur).
Notion de polyclonalité : on parle de sérum polyclonal quand ce sérum est composé de plusieurs Ac reconnaissant des épitopes différents mais portés par la même cellule.
Les différents types d’épitopes :
– Les épitopes séquentiels : c’est la partie de l’Ag en structure linéaire (12 à 18 AA qui se suivent).
– Les épitopes conformationnels : ces épitopes sont composés de parties qui se suivent en 3D.
– Les petits peptides. Ils sont aussi appelés épitopes T. Ils sont séquentiels.
– Les sucres (pour les Lb). Ils sont toujours séquentiels et généralement composés de 5 ou 6 oses répétés plusieurs fois sur le même sucre.
II Les réactions croisées.
Protéine A Protéine B
Ac anti A Ac anti B
L’Ac reconnaît une protéine contre laquelle il n’a pas été formé.
Si la protéine A porte les épitopes a, b, c, d, e, f et g, les anticorps correspondant seront anti-a, anti-b, anti-c, …, anti-g. Si la protéine B porte au moins, un même épitope que la A, il pourra y avoir réaction croisée. Cette réaction est aussi possible si l’épitope ne diffère que d’un AA. La partie de l’Ac qui reconnaît l’épitope s’appelle le paratope.
III Affinité et spécificité.
A Affinité.
Ag + Ac (K1) (K-1) AgAc
K1 est la constante d’association alors que K-1 est la constante de dissociation.
K (constante d’affinité)= K1/K-1.
10^4 < K < 10^11. Quand K a une affinité de 10^4, celle est faible alors qu’une affinité de 10^11 est forte.
L’affinité est la somme des forces d’attraction et de répulsion qui s’établissent entre le paratope et l’épitope.
Remarque : la variation d’un AA peut fortement diminuer K.
B Spécificité.
La spécificité d’un Ac est la capacité de celui-ci à reconnaître un Ag (spécificité de l’Ag).
L’avidité (d’un Ac pour un Ag) : dans certains cas (pour certaine Ig), on peut avoir une association de cinq Ac (Ac pentamérique : les IgM). Ce type d’association permet une meilleure fixation de l’Ag en ayant toutefois un K moyen.
IV Immunogénicité et antigénicité.
• Une molécule est antigénique si elle se fixe sur un paratope.
• Une molécule est immunogénique quand elle déclenche/provoque une réaction immunitaire.
Un haptène : c’est une petite molécule, de faible poids moléculaire (évidemment) qui n’est généralement pas de notre organisme mais qui est trop petite pour pouvoir déclencher une réaction immunitaire. Un haptène est donc antigénique mais pas immunogénique.
Les haptènes peuvent être des sels de métaux lourds (Ni, Cr …), des substances végétales, des produits chimiques de synthèse (pesticides). On se sert d’eux (in-vitro) pour fabriquer des Ac aux pesticides.
Injection dans un lapin
Récupération du sang de lapin avec
des Ac anti-a,anti-b,…,anti-h et un Ac
anti DNP
On teste ensuite les réactions entre ce nouveau sérum d’anticorps et d’autres Ag.
Anticorps + Complexe AgAc
Ova-DNP + +
Ova-NIP + +
BSA-DNP +
BSA-NIP –
Dans le cas de la réaction entre l’Ac anti-DNP et la BSA-DNP, seul l’Ac anti-DNP réagit
Classement croissant des facteurs contrôlant l’immunogénicité :
– La taille doit être suffisante.
– L’Ag doit avoir la structure la plus étrange possible
– La présence d’une structure tridimensionnelle
– La voie d’administration : * quand l’administration est intradermique, il y a une réponse des Lt ; * pour une administration sous-cutanée, on a une réponse des Ac ; * dans le cas d’une administration orale ou nasale on a aussi une réponse par des Ac et en particulier par les IgA ; * par intraveineuse et avec de gros Ag, on aura une réponse forte par des Ac et des macrophages alors que dans le cas de petits Ag solubles, on aura une réponse faible mais efficace.
Le système de l’adjuvant (mélange de substances) : cet adjuvant permet d’augmenter l’immunogénicité de l’Ag. On a deux manières d’action différentes. Il y a création d’une réponse immunitaire de forte importance (réaction inflammatoire) où l’Ag est piégé pour être présenté plus longtemps au système immunitaire : on a alors une augmentation de l’immunogénicité.
L’adjuvant de Freund :
– incomplet : c’est une émulsion d’huiles, d’eau et d’émulsifiants (savons) qui piège l’Ag.
– complet : c’est un complexe d’eau, d’huiles, d’émulsifiants et de morceaux de bactéries tuées (phase 1 et 2).
الفرع / الخيار
عدد المناصب
تاريخ المسابقة
مواد المسابقة
شروط الالتحاق بالمسابقة
علم البيئة الميكروبية للريزوسفيـر:علم جراثيم التربـة
06
17/ 10/ 2022
* علم الجراثيم في المحيـط (الهواء، الماء والتربة)
* علم الجراثيم في المحيـط (الهواء، الماء والتربة)
* الثقافــة العلميــة
*ش.ت.ع في علم الجراثيم
*ش.ت.ع في علم الجراثيم
*مهندس في الهندسة البيولوجية
*مهندس في مراقبة النوعية والتحليل
علم التغذية وعلم الوظائف المرضية وجهاز الأوعية القلبيـّة
06
20/ 10/ 2022
* علم الخلايا، لم الأنسجـة وعلم الأجنـّــة
* الأيض : الغلوسيدات، الليبيدات والبروتينات
* الفيزيولوجيا المعوية و التغذية
*فيزيولوجيا القلب
* ش.ت.ع في علم الجراثيم
*ش.ت.ع في الكيمياء الحيوية
* ش.ت.ع في البيولوجيا وفيزيولوجيا الحيوان
* ش.ت.ع في التعامل
* مهندس في هندسة البيولوجيا
* مهندس في مراقبة النوعية والتحليل
* مهندس في علم الزراعة (خيار: زوو تقني)
2. الدكتوراه:
الفرع /الخيار
عدد المناصب
تاريخ المسابقة
مواد المسابقة
شروط الالتحاق بالمسابقة
علم البيئة النباتية: ديناميكية النظم الإيكولوجية والمحيط
15
* 05 وظائف ل
ـ (ج.هـ.ب.ع.ت)
* 05 وظائف لجامعة الأغواط
* 05 وظائف لجامعة الجلفة
23/ 10/ 2022
1. الميزولوجيـا: بيولوجيا علم المناخ،علم البيئة الترابية، علم شكل الأرض
2. إيكولوجية التوليف : التعايشية، الجغرافيا النباتية، المجتمع النباتي
3. ثقافــة عامــة
4. الإنجليزيـة العلمية
* ش.ت.ع أو مهندس في علم البيئة والبيولوجيا النباتيّـة
* مهندس في البيولوجيا
* مهندس علم البيئـة، جميع الخيارات
* مهندس في الزراعة (خيارات: الزراعة الرعوية، الغابية والنباتية، الزراعة الصحراوية)
تشكيل الملف:
طلب خطي للمشاركة في المسابقة (تحديد العنوان، رقم الهاتف والبريد الإلكتروني)
مستخرج من شهادة الميلاد
نسخة مصادق عليها من شهادة البكالوريا
نسخة مصادق عليها من شهادة التدرج على المدى الطويل
نسخة مصادق عليها من كشف النقاط لدورة التدرج كاملة بما في ذلك علامة التخرج
اثنين (02) صور شمسية
اثنين (02) أظرفة بطابع البريد إلى عنوان المترشح
ملاحظة: سيتم نشر نتائج المسابقة على الموقع الإلكتروني للجامعة.ط§ظ„ظ‡ط§طھظپ 60-50 79 24 21 213+ ط§ظ„ظپط§ظƒط³ 04 79 24 21 213+ ط§ظ„ط¨ط±ظٹط¯ ط§ﻻظ„ظƒطھط±ظˆظ†ظٹ:webmaster@usthb.dz
TP Gram + et Gram
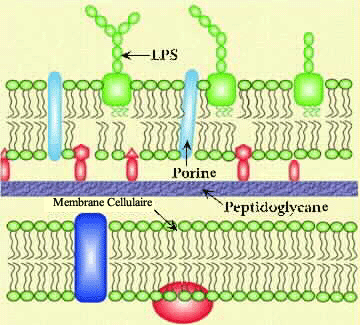
[/color]
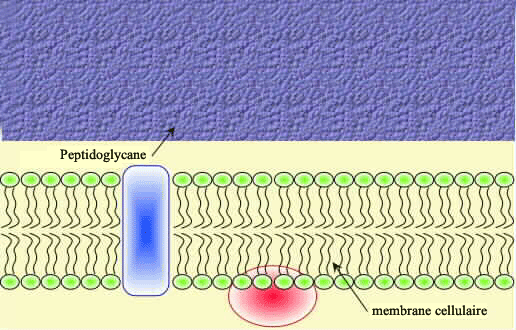
[/COLOR]
</object
ou
Technologie de l’ADN
recombinant
LE LIEN
[web]http://pageperso.lif.univ-mrs.fr/~michel.vancaneghem/optionBio1/documents/clonage.pdf[/web]
