“من المهم للإنسان الذي يسعى لإدراك روح الطبيعة في سبيل الإبداع أو التفسير أن يفتش عن التحولات التي طرأت على صورة الطبيعة نتيجة تطور العلم” هايزنبيرغ فإذا حاولنا أن نضع إطارا لهذه الصورة من منظورنا الخاص وضعنا في البداية بانوراما عامة لمكونات صورة الكون بالشكل التالي:
1- المادة : التي تؤلف كل ما يحيط بنا من المجرات و تعنقداتها من الأبراج و النجوم والكواكب، إلى جميع الأجسام الحية و غير الحية التي تحيط بنا بما في ذلك أجسامنا .
2- المادة السوداء الباردة : التي تعمل على عدم انفلات الكون ، وهروب المجرات عن بعضها هروبا لا نهائيا.كما أنها تمنع انسحاق الكون على نفسه انسحاقا آنيا يعيده إلى big bang جديد.
3- الإشعاع أو الفوتونات : بدءا من أشعة غاما حتى الأشعة المترية الراديوية مرورا بالأشعة السينية و الأشعة فوق البنفسجية و الأشعة المرئية و الأشعة تحت الحمراء الحرارية الفعل و الأمواج الميللي مترية و السنتي مترية. وبالتأكيد هذه العناصر تختلف عن (الماء والنار والتراب) فلقد عمل الفضول والحاجة عبر السنين إلى تفسير كثير من تفاعلات المادة وحالتها وتأثيرات الإشعاع ومصادره وبقيت المادة المعتمة الأكثر غموضا والتباسا وكان القرن الماضي و أواخر ما سبقه متفردا بعلومه وإنجازاته العلمية وخاصة النووية التي بدأت على يد بيكرل عام1896 باكتشافه للإشعاع الطبيعي لأملاح اليورانيوم وذلك محض صدفة وتتابعت الإنجازات في هذا المجال . ومن بين العناصر ذات الإشعاع المكتشفة الرادون الذي تم اكتشافه في عام 1900 على يد دورن Friedrich Ernst Dorn وتحديد خواصه على يد رذرفورد و سودي في عام 1902وربما عرف الفراعنة هذا الغاز وخواصه قبل ذلك بكثير.
الرادون هو أحد نواتج تحلل عنصر اليوارنيوم المشع في سلسلة الإشعاع الطبيعي,إن النشاط الإشعاعي للرادون أي التحلل تلقائيًا إلى عناصر مشعة أخرى يمكنها أن تلتصق بذرات الغبار الموجودة في الجو يتنفسها الإنسان فتلتصق بجدار الرئتين وتقوم بدورها بالتحلل إلى عناصر أخرى، وأثناء هذا التحلل تشع أشعة ألفا ( نواة ذرة الهليوم ) وهي أشعة مؤينة و الأشعة المؤينة تسبب تأين الخلايا الحية؛ وهو ما يؤدي إلى تغيرات كيميائية في الخلية مما يدي إلى أحد أمرين إما تغيرات دائمة في الخلايا وبالتالي حدوث خلل وراثي أو تداخلات متأخرة مثل السرطانات أو تحدث ضررا يؤدي إلى موت الخلايا فموت العضو فموت المتعضية..وخلال العقد الماضي اقر العلماء بإجماع على اعتبار أن غاز الرادون السبب المحتمل للإصابات السرطانية في بني البشر.
ولكن لحسن الحظ فإن مثل هذا النوع من الأشعة ـ أشعة ألفا ـ عبارة عن جسيمات ثقيلة نسبيًا، وبالتالي تستطيع أن تعبر مسافات قصيرة في جسم الإنسان ( الجلد فقط في حالة التعرض الخارجي ) أي أنها لا تستطيع أن تصل إلى خلايا الأعضاء الأخرى لتدميرها؛ وبالتالي يكون سرطان الرئة هو الخطر المهم والمعروف حتى الآن الذي يصاحب غاز الرادون. وتشير التقديرات إلى أنه يتسبب في وفاة ما بين 15 آلاف إلى 22 ألفا في الولايات المتحدة لوحدها نتيجة الإصابة بسرطان الرئة.
وتعتمد خطورة غاز الرادون على كمية ونسبة تركيزه في الهواء المحيط بالإنسان، وأيضًا على الفترة الزمنية التي يتعرض لها الإنسان لمثل هذا الإشعاع، وحيث إن هذا الغاز من نواتج تحلل سلسلة اليورانيوم؛ لذا فهو موجود في التربة والصخور، وتكون نسبة تركيزه عالية جدًا في الأماكن الصخرية أو الحجرية المغلقة، مثل أقبية المنازل والمناجم والفوالق الصخرية ومثل قبور الفراعنة المبنية في وسط الأحجار والصخور، وهذا بالفعل ما وجد عند قياس نسبة تركيز هذا الغاز في هذه الأماكن. وبالتالي يؤدي مكوث الإنسان فترة زمنية طويلة بها إلى استنشاقه كمية كبيرة من هذا الغاز الذي يتلف الرئتين، ويسبب الموت بعد ذلك. وهذا ما ذهب إليه العلماء في تفسير لعنة الفراعنة بأنها تحدث نتيجة لتعرض الأشخاص الذين يفتحون المقابر الفرعونية لجرعة مكثفة من غاز الرادون.يقول ألفرد هوايتد ( 1841 – 1947 ) ” ما من أمر ذي بال إلا و سبقنا أحدهم إلى قوله دون اكتشافه ” كما أن وليدات الرادون تشكل خطورة كبيرة إذا تم أستنشاق الرادون وذلك لكونها صلبة تستقر في الرئة ويمكن أن تنتقل مع الدم إلى أعضاء هامة في الجسم وتترسب بها. كما يستخدم غاز الرادون في اطار بعض العلاجات التي تسمى العلاجات الراديولوجيا والتي تكون بشكل أساسي علاجات بالاستحمام بحمامات مياه ساخنة او ينابيع مياه معدنية ساخنة يكون فيها تركيز الرادون 1 – 4.5 / 6.0 kbq .
◘ الخواص الفيزيائية و الكيميائية للرادون :
الرادون ( Rn ) ( radon ) هو عنصر غازي وحيد الذرة خامل كيماوياً مشع موجود في الطبيعة . وهو عديم اللون والرائحة والطعم، شديد السمية، وإذا تكثف فإنه يتحول إلى سائل شفاف، ثم إلى مادة صلبة معتمة ومتلألئة. وعمر النصف لهRn222 3.38 يوم . يوجد للرادون ثلاثة نظائر :
1 – الأكتنون actinon Rn219 : يهمل عادة هذا النظير عند تقييم الجرعة الإشعاعية الطبيعية وذلك لندرة وجود نظير اليورانيوم235 أساس السلسة التي ينحدر منها هذا النظير من جهة (0.7% من اليورانيوم) وبسبب نصف عمره القصير (3.92ثانية) من جهة أخرى ولذلك يتلاشى هذا النظير قبل خروجه من التربة إلى البيئة.
2 – التورون thoron Rn220 : يعتبر نظيرا مهما وذلك لكون نسبة إنتاجه متساوية تقريبا والرادون222 .
3 – الرادون radon Rn222 .
ينتمي الرادون إلى عامود الغازات النبيلة أو الخاملة في الجدول للعناصر (جدول مندليف) الذي يضم غازات الهليوم و النيون و الأرغون و الكريبتون و الأكزينون. فذرة الرادون كباقي الغازات النادرة نادرا ما تتفاعل و تشكل جزيئات. لذلك يمكنها أن تنتشر بحرية عبر كل المواد النفوذة للغازات لأنها خاملة كيميائيا. و الرادون غاز عديم اللون و الرائحة و لا يمكن كشفة بالحواس البشرية، لذلك يعتمد في كشفه بشكل رئيسي على كشف الأشعة المرافقة لتفككه وتفكك وليداته. غاز الرادون أثقل من الهواء سبع مرات ونصف مما يودي إلى وجوده في الأسفل دائماولكنه يشكل حوالي1 من 1020 من هواء الجو فهو لا يشكل طبقة قريبة من سطح الأرض و إنما يختلط تقريبا بشكل متجانس مع الهواء الداخلي للمنازل حيث يكون تركيز الرادون داخل المنازل بشكل عام أعلى من 2 إلى 10 مرات منه في الخارج لذا فإنه غالبا ما يهمل التعرض للرادون خارج المنازل. يبين الجدول(1) بعض الخواص الفيزيائية للرادون.
الجدول رقم 1
والرادون شديد الذوبان في التلوين. لذلك غالبا ما يستخدم التلوين من أجل استخراج الرادون المنحل في الماء في العينات المائية من أجل قياس تركيز الرادون فيها. و من الجدير بالذكر، أن الرادون متوسط الانحلال في الماء و بعض السوائل الأخرى. يبين الجدول (2) معامل الانحلالية للرادون في بعض السوائل المشهورة. كما يعتبر الفحم الفعالِ ماص جيد للرادون لذلك غالبا ما يستعمل من أجل استخراج الرادون من الماء و من أجل قياس الرادون المعلق في الماء

◘ مصادر الرادون :
إن المصدرين الأساسيين للرادون في الوسط الخارجي هما التربة و الماء فيما يلي شرح مبسط لبعض أهم هذه المصادر.
1-التربة والصخور:
إن حوالي 80% من غاز الرادون المنبثق إلى الوسط الخارجي ينتج عن الطبقة العليا للأرض. وبالطبع فإن وجود الراديوم 226 وبالتالي اليورانيوم 238 هو السبب في إصدار الرادون في التربة وبالتالي تختلف من مكان إلى أخر حسب الطبيعة الجيولوجية وتتركز في الصخور الجرانيتية والفوسفاتية. يعبر عن كمية اليورانيوم الموجود في مكان ما بجزء من المليون من الوزن((ppm أو بالفاعلية النوعية والتي يعبر عنها بالبيكو كوري لليورانيوم في غرام واحد من المادةpci/g والعلاقة بين هذين التعبيرين بالنسبة لليورانيوم هو 1pci/g=1 ppm وبشكل عام فإن صخور القشرة الأرضية تحوي حوالي 1pci/g والتربة حوالي 0.7pci/g .
يمكن تقسيم اصدار الرادون من التربة والصخور إلى مرحلتين المرحلة الأولى تتجلى بالخروج من الفلزات إلى الوسط البيني ،أما المرحلة الثانية فتتجلى بالخروج من هذا الوسط إلى الهواء.فكل تفكك لذرة راديوم موجودة في حبيبات التربة أو الصخور سيعطي ذرة رادون. فإذا كان إنتاج هذه الذرة قريب من سطح التربة فيمكنها الهروب إلى الوسط الخارجي. إن كمية إصدار الرادون من التربة تتوقف على عدة عوامل منها النفوذية ورطوبة التربة،…الخ.، وتؤثر أيضا عملية تفككه ليعطي عنصرا صلبا هو البولونيوم قبل أن يبلغ السطح في معظم الأحيان, يعرف معدل الإصدار على أنه الفعالية المنطلقة بواحدة المساحة بواحدة الزمن.وتعرف كمية الرادون القابلة للتحرر إلى الغلاف الجوي بواسطة معامل يدعى معدل الإنتاج للرادون:
P=E.R.λ
حيث: : λثابت التفكك للرادون (2.06*10-6 s-1 )
E : معامل الإصدار
R : النشاط الإشعاعي للراديوم في المنطقة (الوسط المدروس)
كما يعرف معدل التحرر(الأنبثاق) الكليT بالشكل:
T=P.ρ= E.R.λ.ρ
حيث ρ : كثافة جسم المادة (kg/m3 )
يعتمد إصدار الرادون من التربة على كمية انبثاقه من حبيبات مادة التربة وعلى انتقالية (انتشاره) عبر مسامات التربة إلى الوسط الخارجي. وقد وجد أن معامل انبثاق الرادون بشكل عام من الصخور أكبر منه من التربة و المعادن.
2- الماء:
يعتبر الرادون متوسط الانحلالية في الماء، حيث تزداد انحلاليته بنقصان درجة حرارة الماء. لذلك عندما تسير المياه الجوفية الباردة عبر صخور التربة الجوفية تمتص كمية لا بأس بها من الرادون. عندما يسخن الماء أو يحرك فإن كمية كبيرة من الرادون تنفلت و تنطلق إلى الوسط الخارجي.
تعتمد بشكل رئيسي كمية الرادون في الماء على عاملين: الأول هو المواصفات الجيولوجية المحلية ، و الثاني نوع الماء. فمن أجل العامل الأول فقد ذكرنا في الفقرة السابقة أن كمية الرادون تعتمد على نوع و مواصفات الصخور الموجودة. أما نوع الماء المستخدم فهو عامل مهم جدا، حيث وجد أن الرادون الناتج عن الماء يشكل مشكلة في البيوت التي تستخدم مياه الآبار بشكل مباشر، بينما لا يكون مشكلة في البيوت التي تعتمد على شبكة المياه العامة. وذلك لأنه عادة يتم حفظ مياه الشبكة العامة من أجل المعالجة و من ثم التخزين و بعد ذلك التوزيع الوقت الذي يتفكك فيه الرادون و نواتج تفككه المنحلة في الماء قبل أن يصل البيوت.
لقد قدر بشكل عام أن تركيزه قدره 10000 بيكو كوري باللتر من الرادون بالماء سيضاف حوالي 1 بيكو كوري باللتر (37Bq/m3) في الهواء الداخلي للمنازل بافتراض الاستخدام العادي للماء. وقد وجد أن متوسط مستوى الرادون في مياه الآبار يتراوح بين 500 و 170000 بيكو كوري باللتر.
يمكننا تحديد ثلاث مصادر رئيسية لغاز الرادون في المياه السطحية
1 – الرادون الناتج عن الرادويوم 226 الموجود في المحلول و المعلقات .
2 – الرادون المترافق مع تدفق المياه الجوفية .
3 – انتشار غاز الرادون مع الرسوبيات المتوضعة في الأسفل .
يتم فقدان الرادون بسرعة من المياه السطحية إلى الجو بواسطة الانتشار ولذلك تشارك المحيطات بحوالي 1% من كمية الرادون الصادرة إلى الوسط الخارجي ويعود ذلك إلى أن محتوى ماء البحر من اليورانيوم و الراديوم أصغر بكثير من محتوى التربة و الصخور.
وأما في المياه الجوفية فيعزى وجود الرادون في المياه الجوفية إلى تفكك الراديوم الموجود في الصخور و التربة و الذي انحل في هذه المياه و إلى الرادون المنحل في هذه المياه الجوفية و الناتج من تفكك الراديوم غير الموجود على تماس مع هذه المياه .
3 – مواد البناء:
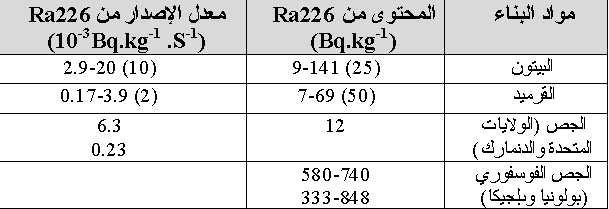
تحوى مواد البناء المصنوعة من التربة و الصخور مثل (الإسمنت، البلوك،… الخ) على مواد مشعة ذات منشأ طبيعي مثل اليورانيوم و الراديوم و بالتالي فهي تولد الرادون. لهذه المواد نفوذية كافية لينطلق الرادون المتولد ضمنها إلى الوسط الخارجي. أما المواد ذات المنشأ غير الأرضي (مثل الخشب) فهي تحوي كمية منخفضة جدا من الراديوم. تختلف كمية الرادون الصادرة عن نوع معين من مواد البناء بشكل كبير من عينة إلى أخرى حتى ولو كان تركيز اليورانيوم في كلا العينتين واحدا.حيث وجد أن معدل إصدار الرادون يتغير مع الظروف البيئية والتي أهمها الرطوبة و الضغط.وذلك يعود لتأثير الرطوبة والضغط على إرتداد ذرة الرادون الناتجة عن التفككات الإشعاعية للراديوم. يبين الجدول ( 3 ) محتوى مواد البناء من الراديوم 226 و معدلات الإصدار لكل منها :
الجدول رقم 3 وضعت القيم النموذجية بين قوسين
– هناك نوعين لقياس الرادون :
فعالة (active) أي تحتاج الى طاقة خارجية لتعمل منفعلة(passive) ولا تحتاج إلى طاقة خارجي وتستخدم أنظمة القياس الفعالة من أجل القياسات الصغيرة أما المنفعلة فمن أجل القياسات الطويلة.
1- طريقة التألق ( خلية لوكس):
تعتمد على كشف التألق الناتج عن صدم جسيمات ألفا الناتجة عن تفكك الرادون ووليداته بمادة تألق مثل كبريتات التوتياء (zns) ضمن حيز محكم الإغلاق .
الطريقة: يدخل الهواء المراد قياس الرادون فيه إلى الخلية بواسطة مضخة عبر فلتر من أجل إزالة نواتج تفكك الرادون الصلبة. تترك الخلية بعد ذلك إلى أن تصل إلى التوازن المستقر مع نواتج تفككه قصيرة العمر.
توضع الخلية فوق مضاعف ضوئي لتعد التألقات الصادرة عنها لفترة زمنية مناسبة,
بحيث لا ينقص تركيز الرادون بالتفكك الإشعاعي خلال تلك الفترة الزمنية, إن كل تفكك لذرة رادون يقابلها إصدار مباشر لثلاث جسيمات ألفا حيث أن الرادون بتوازن مستقر مع نواتج تفككه قصيرة العمر.
إن فعالية الخلايا المتوفرة تتراوح بين 70إلى 80 بالمئة لأسباب كثيرة لذلك يختلف معامل التحويل الذي يحول عدد التألقات إلى تركيز الرادون من خلية إلى أخرى حسب حساسية المضاعف الضوئي والخلية نفسها .
وتتم عملية المعايرة عادة بضخ عينة هواء عيارية تحوي غاز الرادون إلى الخلية ثم يتم عد الخلية بعد انتظار 3ساعات فيكون معامل التحويل لهذه الخلية هو تركيز الرادون العياري مقسوم على قيمة التعداد الحاصل خلال هذه الفترة المحددة .
حساسية هذه الطريقة بحدود 30 Bq/m3.
2- حجرة التأين:
هي مكثفة تكون عادة على شكل اسطواني يولد حقل كهربائي بين لبوسيها, يدخل الهواء المراد قياسه عبر فلتر إلى الحيز الفعال ويترك لمدة 3ساعات ليصل إلى حالة التوازن المستقر مع وليداته القصيرة العمر.
مبدأ عمل هذه الطريقة هو جمع التأينات الحاصلة نتيجة التفكك الإشعاعي للراد ون ووليداته بين لبوسي حجرة التأين , يولد هذا الجمع تيار من النبضات يتم عدها . يمكن حساب تركيز الرادون من خلال عدد النبضات المسجلة خلال فترة زمنية معينة .
حساسية هذه الطريقة 500 Bq/m3.
3- طريقة الفحم الفعال:
تعتمد على خاصية الفحم الفعال في امتصاص وحفظ غاز الرادون ونواتج تفككه, يمكن أن يحدد تركيز الرادون الممتص باستخلاصه إلى عداد التألق السائل, أو باستخدام كاشف أشعة غما لتكشف أشعة غما للرصاص-214 والبوزموت-214,الفحم الفعال يمتص الرادون بدرجة حرارة منخفضة(-70 C) ويعيد إصداره عند الدرجة (300 C) حيث يجمع ويعد بإحداى الطرق السابقة.
حساسية هذه الطريقة 5 Bq/m3.
4- طريقة الفلترين:
يتم قياس تركيز الرادون بقياس تركيز وليدته البولونيوم-218. يضخ الهواء الحاوي على الرادون إلى أنبوب اسطواني يحوي فلترين على فتحتيه, يسمح الفلتر الأول للرادون داخل الأنبوب بالتفكك إلى البولونيوم-218 تترسب هذه الذرات على فلتر المخرج , ويوضع بعد ذلك هذا الفلتر على كاشف الحاجز السطحي الذي يكشف جسيمات ألفا وبذلك يقاس فعالية ألفا الموجودة على الفلتر من هذه الفعالية يمكن حساب تركيز الرادون الذي مر من خلال الأنبوب .
لهذه الطريقة مردود منخفض لترسب البولونيوم على جدران الأنبوب قبل أن يصل إلى الفلتر وقد تم تطوير هذه الطريقة بما يلي:
1) وضعت معادلات لحساب معاملات التصحيح اللازمة من أجل ترسبات الجدران.
2) طبق حقل كهربائي لتجميع الشحنات الموجبة لذرات البولونيوم-218.
3) وضع الكلور بشكل رذاذ داخل الأنبوب لتخفيض ترسب البولونيوم-218 على الجدران.
4) تمكن سترونغ من وضع كاشف الحاجز السطحي داخل الأنبوب ليقابل فلتر الخروج ليقيس فعالية الفلتر خلال عملية أخذ العينة. إن حساسية هذه الطريقة 2 pci أي 72 Bq/m3.
5- مقياس سويات العمل:
ويعتبر هاما في ربط الخطر الصحي بتركيز الرادون . والمبدأ هو:
ضخ الهواء الحاوي على الرادون ووليداته عبر الفلتر , تعد بعد ذلك جسيمات ألفا الصادرة عن نواتج تفكك الرادون المترسبة على الفلتر بكاشف الحاجز السطحي . يحدد مستوي العمل للرادون من معدل تدفق الهواء عبر الفلتر ومعدل عد جسيمات ألفا وفق المعادلة :
WL=cpm/e.v.k
Cpm عدد جسيمات ألفا بالدقيقة , E فعالية الكاشف , V حجم الهواء , K معامل المعايرة
سلبيات هذه الطريقة:
1) التأخر في عملية العد يجعل كمية من ذرات البولونيوم -218 تتفكك قبل أن تعد .
2) طريقة مكلفة.
3) غير مناسبة لعمل الحقل حيث تحتاج إلى مزود طاقة خارجي.
وتم التغلب على هذه السلبيات حيث بني كاشف داخل الجهاز يعمل عن طريق مدخرات قابلة للشحن. وتعد تفككات ألفا الناتجة عن وليدات الرادون المترسبة على الفلتر بشكل مستمر مباشرة خلال عملية الضخ.
6- الطريقة التكاملية:
تستخدم من أجل القياسات طويلة الأمد لتحديد تركيز الرادون في مكان ما. وتستخدم في هذه الطريقة كواشف الجسم الصلب للآثار النووية.
– سنتحدث الآن عن بعض طرائق قياس غاز الرادون في الماء :
– طرق قياس غاز الرادون في الماء:
يمكننا الحديث عن قياس غاز الرادون في الماء تحديدا وهنا نقسم العمل إلى مرحلتين أساسيتان:
المرحلة الأولى:
الإعتيان : وهي عملية جمع العينات و التعامل معها حيث يمكن أخذ العينة من الصنبور أو البئر أو الخزان كما يجب أن نتجنب فقدان أي جزء من الغاز أثناء جمع العينة.
المرحلة الثانية :
القياس و هناك طرق عديدة سنهتم بالطرق التي تتعلق بالنوى المشعة:
طريقة العداد الوميضي السائل :
و هي من أكثر الطرق شيوعا،يمكن استخلاص الرادون بواسطة الخليط الومَاض ومن ثم يتم قياسه بعد ثلاث ساعات من الاستخلاص حيث يكون الرادون على توازن أبدي مع منتجات تفككه ، تمزج العينة عادة أو تعلق في خليط السائل الومَاض و يوضع المزيج في قارورة تعداد زجاجية للقياس. و بالتصادم تنتقل طاقة جسيمات ألفا أو بيتا من النكليون المشع إلى جزيئات المذيب فتتهيج جزيئاته ،و تعود إلى حالتها المستقرة عن طريق الفلورة من الدرجة الأولى أو تحتفظ الجسيمات بالطاقة حتى تصطدم بجزيئات المادة الوماضة التي يجب أن تكون طاقة تهيجها أقل من طاقة تهيج المذيب .
تتهيج جزيئات المادة الوماضة ثم تتخلى عن طاقتها لتستقر بإصدارها لفوتونات ضوئية، وبالتالي يمكن تجميع ضوء الومضات الذي تتناسب كثافته مع جسيمات بيتا و قياسه في عداد وميض السائل.
طريقة تعداد شيرنكوف :
لوحظ شعاع شيرنكوف لأول مرة من قبل العالمة كوري عام 1910 ، ثم درسه شيرنكوف وبدأ استخدامه في نهاية الأربعينيات في الفيزياء النووية و بعد ذلك في التحليل الإشعاعي للنكليونات المشعة ،
يتشكل إشعاع شيرنكوف عندما تعبر جسيمة بيتا المشحونة وسط ما بسرعة كبيرة فتقدم طاقتها إلى جزيئات الوسط فتؤدي إلى استقطابها و لدى عودة هذه الأقطاب المتشكلة إلى حالتها الطبيعية تصدر ضوءا ضعيفا و موجها مؤلفا من أمواج ضوئية في المنطقة فوق البنفسجية . ثم يتم قياس هذا الضوء الصادر بوساطة عداد وميض سائل ، يشترط لتشكل إشعاع شيرنكوف أن تكون طاقة جسيمات بيتا الصادرة من النكليون المشع أعلى من (256kev) ، وبالتالي فإن كافة النظائر التي تصدر جسيمات بيتا ذات طاقة أقل من هذا الحد لا تشكل إشعاع شيرنكوف (مثل التيريتيوم و الكربون –14) .
و من النظائر التي تشكل إشعاع شيرنكوف في المحاليل المائية (الفوسفور-32 و البوتاسيوم-40)
العوامل المؤثرة في إشعاع شيرنكوف :
طاقة جسيمات بيتا – قرينة انكسار الوسط حجم العينة المقاسة – طبيعة قارورة التعداد ، تقاس إشارة شيرنكوف بواسطة و ليدات الرادون ، البزموت –214 و الرصاص-214 التي تصدر أشعة بيتا بعد 3 ساعات من عملية الاستخلاص بواسطة عداد وميض سائل.
– مبدأ عمل الكواشف:
عندما تسقط جسيمات ألفا على الكاشف تفقد طاقتها على خط محدثة منطقة مخربة تدعى الأثر الكامن, وتكون هذه المنطقة عبارة عن مخاريط بقطر3-10نانومتر لا ترى إلا بالمجهر الالكتروني ويتم تكبير هذا الأثر باستخدام محت كيميائي مثل :
ماءات الصوديوم(naoh). حيث يقوم هذا المحلول بحت مكان دخول جسيمات ألفا بسرعة, وتسمى السرعة التي يحت بها المحلول الكاشف سرعة الحت السطحي VB وهي ثابتة تتعلق بنوع الكاشف. بينما السرعة التي يحت بها المنطقة المخربة بفعل جسيمات ألفا بسرعة حت الأثر ويرمز لها VT وتتعلق بكميات التخريب المحدث وبنوع الكاشف. الشرط الأساسي لكي تظهر الآثار هو أن تكون VB<<VT.
إذا وضعت قطعة من هذا الكاشف في علبة, ووضعت العلبة في مكان يحوي غاز الرادون يمكن ربط عدد الآثار المسجلة والظاهرة بوسطي تركيز الرادون في هذا الجو.
ولإيجاد معامل التحويل الذي يربط تركيز الآثار بتركيز الرادون تعَرض كواشف من نفس المادة إلى تركيز معروف (عياري)من غاز الرادون ولأزمنة مختلفة ومن ثم يرسم الخط البياني يمثل تغير تركيز الآثار بتغير زمن التعرض فيكون ميل الخط الحاصل هو المعامل.
تزرع هذه الكواشف تحت سطح التربة من أجل قياس تركيز الرادون في التربة وذلك بحفر حفرة شاقولية اسطوانية ويتم وضع حجيرات القياس في أسفل الحفر بحيث يكون الرشح الورقي نحو الأسفل وتفصل الحجيرة عن التربة في قعر الحفرة بأنبوب بلاستيكي له نفس قطر الحجيرة وارتفاعها. تترك هذه الحجيرة في التربة لمدة 20يوم, تعد بعد ذلك الآثار المسجلة على الكاشف بعد عملية الحت, ويحول تركيز الآثار إلى تركيز وسطي لغاز الرادون داخل التربةبمعامل مناسب.
– تطبيقات قياس الرادون في التربة:
1- قياس الرادون كدليل على استكشاف اليورانيوم:
من أهم تطبيقات قياس غاز الرادون في التربة هو استكشاف مواقع خامات اليورانيوم في باطن الأرض . في هذه الحالة عادة ما تستخدم كواشف الأثر النووي داخل وعاء يسمح بانتشار غاز الرادون إلى الداخل من خلال ورقة ترشيح , وقد أصبحت هذه الطريقة جزءا أساسيا من برنامج التنقيب عن اليورانيوم قبل بدء عمليات الحفر
ويتم ذلك عن طريق إنشاء شبكات قياس هندسية لغاز الرادون في التربة توضع في أعماق تتراوح بين 60-200 cm حسب طبيعة التربة ومن ثم تجمع البيانات ومقارنتها و يتم ملاحظة الشذوذ.
2- قياس الرادون لأغراض التنبؤ بالزلازل :
يستقر الرادون داخل مسامات الصخور أو في المياه الجوفية أو في البترول شأنه في ذلك شأن غازات التربة الأخرى.
ويتسرب إلى الخارج بمعدلات معينة قد تزيد أو تنقص حسب الطبيعة الجيولوجية للمنطقة وفي عام 1972 اكتشف العالم السوفييتي سادوفسكي ومجموعته حدوث زيادة كبيرة في تركيز غاز الرادون المتسرب من باطن الأرض تزامنت مع حدوث زلازل في طشقند . حيث تم التأكد من إن زيادة معدل تسرب الرادون ينتج عن الأضطرابات في باطن الأرض حيث يصل معدل إصدار الرادون من التربة إلى 100 ضعف أحيانا مما كان عليه في الحالة المستقرة.
3- قياس الرادون للتنبؤ باندفاع البراكين :
نشرت العديد من الأبحاث عن علاقة تغير تركيز غاز الرادون في التربة والمياه الجوفية وزيادة أنشطة البراكين. وذلك كنتيجة للإضطرابات الشديدة في باطن الأرض المرافقة لثورة البركان وتغير الحرارة والضغط باتجاه ايجابي مما يؤدي إلى انتشار الرادون المنحل في المياه الباطنية وتسربه من الحجرات الباطنية الطبيعية داخل القشرة الأرضية.
– الخاتمة:
بما إن القشرة الأرضية تحوي في مكوناتها السلاسل الإشعاعية (أنضر للملحق) بالإضافة إلى العناصر المشعة المستقلة. فنستطيع القول أن الأرض التي نعيش عليها هي أحد المصادر الرئيسية للإشعاع الطبيعي، أما المصدر الثاني للإشعاع الطبيعي فهو الأشعة الكونية التي اكتشفها الفيزيائي الأمريكي هس في عام 1911م.
وهذه الأشعة هي في الحقيقة ناتجة من التفاعلات النووية الهائلة التي تحدث في النجوم. وتتكون الأشعة الكونية من بروتونات وجسيمات ألفا وبيتا ونوى أخرى حيث تتفاعل مع نوى ذرات الغلاف الجوي للأرض مما يولد إشعاعات غاما وإلكترونات سريعة بالإضافة إلى النيترونات والميزونات. وبما أن هذه الإشعاعات متأينة فإنها تتأثر بالمجالات المغناطيسية للأرض مما يجعل منطقة القطبين أكثر تأثرا من المنطقة الاستوائية، وأيضا كلما ارتفعنا عن مستوى سطح البحر زادت الجرعة من هذه الإشعاعات.
أي يمكننا القول أن الخطر الأكبر في الحالة الطبيعية لتعرض الإنسان إلى الخطر الإشعاعي الطبيعي يتمثل في استنشاق الرادون بكميات كبيرة وعلى فترات زمنية طويلة لذلك لابد لنا أن نتقي هذا الخطر وان نعمل على تقليله وذلك في اتجاهين : الأول عام وذلك عن طريق بناء خزانات للمياه العامة يتم فيها التخلص من غاز الرادون وإجراء مسح دوري لقياسه في شبكة المياه العامة, وأيضا إقامة نضم تهوية طاردة في مناجم الفحم والفوسفات واليورانيوم…إلخ.وتغطية النفايات المشعة بمواد عازلة للإشعاع وللهواء.
و الثاني اتجاه فردي يتمثل في تهوية المنازل والأقبية و الأماكن المغلقة وترميم الصدوع .
وكما يمكننا الاستفادة من قياس غاز الرادون كما ذكرنا سابقا في التنبؤ بالزلازل والبراكين وتحديد مكامن العناصر المشعة. ويجدر بنا القول أن استنشاق غبار العناصر المشعة الأخرى يؤدي إلى ذات الخطر الذي يمثله الرادون لا بل خطر أكبر وخصوصا إذا كان العنصر من أعلى السلسة المشعة وإذا كان نشطا كيميائيا يمكنه التفاعل وتشكيل أملاح يمكنها الترسب في مناطق نشطة بيولوجيا مثل الكبد والغدد ونقي العظام وبالتالي يكون الخطر أكبر بأضعاف ما كان عليه بالنسبة للرادون وكمثال على ذلك استخدام اليورانيوم المستنفذ في الأسلحة.
ان شاء الله تكونوا استفادتو من الموضوع ..
























 الشكل (2-3): علاقة الترابط بين الذرات بطاقتها.
الشكل (2-3): علاقة الترابط بين الذرات بطاقتها.