¤||¤ الســـــــ عليكم ورحمــــ الله ـــــة وبركاته ـــــــلام ¤||¤
مـــــا رأيــــكم بالشاي المزعفــــــر …

¤||¤*..*¤||¤
¤||¤ *..* ¤||¤ الزعفــــــــ” Saffron “ــــــــــران ¤||¤ *..* ¤||¤
قال عليه الصلاة والسلام :-
“إنها لبنة من ذهب ولبنة من فضة، بلاطها طينتها المسك، وترابها الزعفران، وحصباؤها اللؤلؤ والياقوت، من يدخلها ينعم ولا يبأس، ويخلد ولا يموت، لا تبلى ثيابهم ولا يفنى شبابهم ” .. رواه الترمذي..
ترابهـــا الزعفــــران 
استمــــــع معي رعــــــاك الله ..في رحــــــــاب الجنـــــــــة .. نبيــــــل العوضـــي
اللهم إنــــا نسألك الجنة ومايقرب إليها من القول و العمل
 – * – * – * –
– * – * – * –  – * – * – * –
– * – * – * – 
الزعفــــران : – نبات بصلي من فصيلة السوسنيات، والجزء الفعال في الزعفران أعضاء التلقيح وتسمى (السّمات)…


![]()
¤||¤ الزعفــــــــران لغــــــة ¤||¤
من الناحية اللغوية بأن ( الزعفران ) جمعه ( زعافر ) وكانت العرب تستخدمه لصبغ الأقمشة النسيجية فيقال (زعفر) الثوب صبغه به وباللغة اللاتينية يدعى الزعفران Crocussativus
¤||¤ استخــــــــراج الزعفـــــــــــران ¤||¤

ويستخرج الزعفران من زهرة صغيرة يوجد في قلبها خيوط الزعفران ويتم استخراجها بدقة متناهية وبأيدي أشخاص ذو خبرة وفن في التقاطها وتجميعها وزراعة الزعفران من النباتات المكلفة في زراعته ماديا وفنيا وتقنيا لذا اصبح سعره باهظ الثمن وخصوصا الأنواع الفاخرة منه والتي يتم زراعتها في إيران حيث أن الحصول على 500 غرام منه يتطلب زراعة ما لا يق عن 70.000 زهرة يجب أن تكون جميعها صحيحة وصالحة ، كما أن الزعفران الطازج حيت يتم تجفيفه يفقد الكثير من وزنه فالخمسة وعشرون كيلو غرام منه يصبح بعد التجفيف حوالي خمسة كيلو غرامات فقط
¤||¤ قطــــــاف الزعفــــــــران ¤||¤
يستمر تزهير النباتات على مدى 3-4 أسابيع وبذلك تمدد فترة قطاف الأزهار من نهاية شهر أيلول حتى بعد منتصف تشرين الأول حيث تلعب ظروف الطقس من درجات الحرارة دوراً في عملية التزهير وتفتح الأزهار ونضجها تحتاج عملية قطاف الأزهار التي تجري عادة في وقت مبكر من الصباح ( ساعات انتشار قطرات الندى) تحتاج إلى إعداد كبيرة من الأيدي العاملة تجمع الأزهار الناضجة كاملة التفتح ضمن خطوط الزراعية توضع بعدها في سلال خاصة تحمل من قبل العاملات عادة بأسلوب خاص وبحرفية وحرص شديدين مع الانتباه إلى عدم تعريض الأزهار لأضرار ميكانيكية تؤدي إلى تلف سمات الأزهار وضمن خطوط استخلاص مادة الزعفران يتم تجفيف الأزهار المقطوفة تحت الظل بعد فرشها على بساط تعقبه عملية قشر الأزهار واستخلاص السمات منها بطريقة لا تخلو من مهارة قد تؤثر على نوعية المادة واستخلاص السمات في ضوء ممارسة العمل ومع مرور الزمن 0
 – * – * – * –
– * – * – * –  – * – * – * –
– * – * – * – 
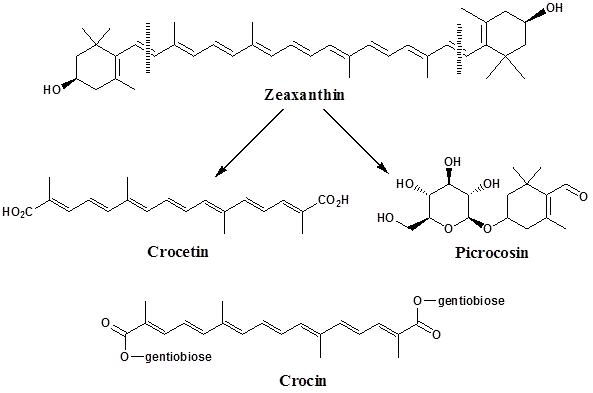
¤||¤*..*¤||¤كيميـــــــــاءالزعفـــــــــــران¤||¤*..*¤||¤
.. * .. التــــركيب الكيميــــائي .. *..

 – * – * – * –
– * – * – * –  – * – * – * –
– * – * – * – 
جينتوبيــــوس : Gentobiose

الصيغــــة الكيميــــائية : C12H22O11
الـــــوزن الجــــزيئي :342.308
الكروستيـــــــن :Crocetin
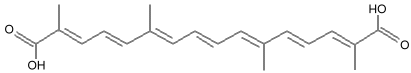
الصيغــــة الكيميــــائية : C20H24O4
الـــــوزن الجــــزيئي :328.412
كروسيــــــن: Crocin

الصيغــــة الكيميــــائية : C44H64O4
الـــــوزن الجــــزيئي : 976.996
 – * – * – * –
– * – * – * –  – * – * – * –
– * – * – * – 
الدهون والزيوت والأحماض الدهنية Fats , Oils and Fatty Acids..
: .. : الــدهـــــــون : .. :
5.85 جرام
: .. : الدّهن الغير مشبّع أحادي : .. :
0.429 جرام
: .. : الدّهن الغير مشبّع المتعدد : .. :
2.067 جرام
حمض الأولييك Oleic acid
0.39 جرام

الاسم العام ” الشائع ” : Oleic acid
الاسم العلمي : ” 9-Octadecenoic acid”
الصيغة الكيميائية :C18 H34 O2
الذائبية : لا يذوب في الماء
درجة الغليان :286درجة سيليزية
درجة الانصهار : 13.4 درجة سيلزية
الكثافة :0.891


حمض البالميتوليك Palmitoleic acid
0.003 جرام
الاسم العام ” الشائع ” : Palmitoleic acid
الاسم العلمي : ” 9-Hexadecenoic acid “
الصيغة الكيميائية : C16 H30 O2
درجة الغليان :—-درجة سيليزية
درجة الانصهار : 30.6درجة سيلزية
الكثافة :0.867
اللزوجة : 4.37

 – * – * – * –
– * – * – * –  – * – * – * –
– * – * – * – 
حمض اللينوليك Linoleic acid
0.754 جــــرام
الاسم العام ” الشائع ” : Linoleic acid
الاسم العلمي : ” 9,12-Octadecadienoic acid”
الصيغة الكيميائية : C18 H32 O2
درجة الغليان :229-230درجة سيليزية
درجة الانصهار : -5 درجة سيلزية
الكثافة :0.902
اللزوجة : —

حمض اللينولينك Linolenic acid
1.242 جــــرام
الاسم العام ” الشائع ” : Linolenic acid
الاسم العلمي : ” 9,12,15-Octadecatrienoic acid”
الصيغة الكيميائية : C18 H30 O2
درجة الغليان :230-232درجة سيليزية
درجة الانصهار : -11درجة سيلزية
الكثافة :0.914
اللزوجة : —

 – * – * – * –
– * – * – * –  – * – * – * –
– * – * – * – 
.. الامـــلاح والمعـــادن Salts and Minerals ..
: .. : الكالسيـــوم : .. :

110.9 مجم
: .. : النّحــــاس : .. :

0.328 مجم
: .. : الحديـــــد : .. :

11.1 مجم
: .. : المغنيسيــــوم : .. :

264 مجم
: .. : المنجنيز : .. :
28.408 مجم
 – * – * – * –
– * – * – * –  – * – * – * –
– * – * – * – 
: .. : البوتاسيوم : .. :

1724 مجم
: .. : الصّوديــــوم : .. :
148.2مجم
: .. : الزنــــــك : .. :
1.09 مجم
: .. : الفوسفـــــور: .. :

252.1 مجم
 – * – * – * –
– * – * – * –  – * – * – * –
– * – * – * – 
الفيتـــــــــــــامينــــــــــات Vitamins

فيتـــــــــاميــــــــن ب 1 (ثيامين) ( Thiamine )

0.115 ملجم
الاسم العام ” الشائع ” : Vitamin B1
الاسم العلمي : ” Thiamine , thiamin , aneurin”
الصيغة الكيميائية :C12H17CIN4OS
الوزن الجزيئي : 337.29
فيتــــــــــاميــــــــن ج أو حمض الأسكوربيك ( Ascorbic Acid , Vitamin C )

80.8 مجــــم
الاسم العام ” الشائع ” : Vitamin C
الاسم العلمي : ” Ascorbic Acid ,Ascorbate ,L-xyloascorbic acid”
الصيغة الكيميائية :C6H8O6
الوزن الجزيئي : 176.1256
 – * – * – * –
– * – * – * –  – * – * – * –
– * – * – * – 
: .. : الكربـــوهيــــــــدات : .. :
65.37 جرام
: .. : البروتيـــــــن : .. :
11.432 جرام
: .. : الرّمـــــاد : .. :
5.448 جرام
: .. : ا لمـــــــاء : .. :


11.898 مجـــــم
 – * – * – * –
– * – * – * –  – * – * – * –
– * – * – * – 




 – * – * – * –
– * – * – * –  – * – * – * –
– * – * – * – 

……. pH ……..
2.0 – 14.0

 – * – * – * –
– * – * – * –  – * – * – * –
– * – * – * – 
¤||¤ أنــــواع الزعفــــــــران ¤||¤
سارجــــول ” Sargol “

بشـــالي ” Pushali “

المجموعة ” Bunch “

![]()
 – * – * – * –
– * – * – * –  – * – * – * –
– * – * – * – 
¤||¤ فــوائــــــد الزعفــــــــران ¤||¤
 نبــات الزعفـــران يقـــوّي البصـــر
نبــات الزعفـــران يقـــوّي البصـــر
يعتبر الزعفران من أهم البهارات التي تستخدم بكميات كبيرة في العديد من الأطباق الرئيسة في المنطقة العربية وخاصة في المغرب وبلاد الشام وشبه الجزيرة العربية.
وحسب كلام خبراء النباتات فإن الزعفران الذي يصنف من فصيلة النباتات السوسنية يحتوي على مادة مقوية للأعصاب، لذلك فهو منشط للجهاز العصبي ومنبه، كما يساعد المرأة على معالجة آلام الدورة الشهرية, مشيرين إلى أن الأجزاء العليا من زهرته تستخدم في طب الأعشاب لاحتوائها على نسبة من مادة “ريتينول التي تقوّي البصر وتحسّن عمل العين.
وأثبتت الدراسات الغذائية أن إضافة العنبر إلى الزعفران يجعله أحد المواد المقوية جنسيا، محذرة من أن تعاطيه بكثرة قد يؤدي إلى الإصابة ببعض الأعراض السلبية مثل الصداع والوهن والأرق في بعض الأحيان, ويمكن أن يضر بالصحة, إذا أضيف إلى الطعام بكميات كبيرة دون معيار مناسب

 الزعفران لمقاومة للسرطان و الوقائية
الزعفران لمقاومة للسرطان و الوقائية
في أحدث دراسة نشرتها مجلة “الطب والبيولوجيا التجريبية” المتخصصة, أثبت باحثون في المكسيك أن بالإمكان إستخدام الزعفران, وهو نوع من النباتات التي تضاف إلى الطعام كأحد التوابل والبهارات لإضفاء النكهة, كعامل واق من السرطان أو في البرنامج العلاجي المخصص لهذا المرض.
و وجد الباحثون بعد مراجعة مجموعة كبيرة من الدراسات المخبرية والأبحاث التي أُجريت على الحيوانات, أن الزعفران لا يمنع فقط تشكل أورام سرطانية جديدة، و لكنه قد يسبب تقلص و إنكماش الأورام الموجودة, كما يزيد فعالية العلاج الكيماوي ويشجع آثاره المضادة للسرطان.
وأوضح الباحثون أن الفوائد الصحية للزعفران قد ترجع بصورة جزئية إلى محتواه العالي من المركبات التي تعرف بالكاروتينويد التي تشمل أيضا مادتي “لايكوبين” و”بيتاكاروتين” كعوامل وقاية و علاج من السرطان.
وتقترح الدراسات أن الإكثار من تناول الفواكه والخضراوات, وخاصة من العائلة البصلية, مثل الملفوف والبروكولي والقرنبيط, قد يساعد في الوقاية من أمراض سرطانية معينة.

 – * – * – * –
– * – * – * –  – * – * – * –
– * – * – * – 


 الأمريكيوم Americium
الأمريكيوم Americium