Dans notre corps, les protéines assurent de nombreux rôles (protéines structurales, enzymatiques, motrices, de transport, de l’immunité, de circulation de l’information, etc.). Ces protéines se renouvellent sans cesse, à raison d’au moins 250 à 300 grammes par jour ! De ce fait, il est impératif de fournir chaque jour à notre organisme une quantité de protéines d’origine alimentaire suffisamment importante pour permettre de compenser ces pertes protéiques. Or, une protéine ne peut être synthétisée que si tous les acides aminés prévus dans sa composition sont disponibles. Si un seul acide aminé manque, aucun autre ne saurait lui être substitué : la protéine ne peut donc être fabriquée et le bilan azoté est négatif (autrement dit, on perd plus de protéines qu’on n’en fabrique).
Le corps humain est capable de fabriquer certains acides aminés, mais d’autres doivent impérativement être puisés dans la nourriture car notre organisme est incapable de les synthétiser. Ces acides aminés indispensables, ou essentiels, sont : l’histidine, l’isoleucine, la leucine, la lysine, la méthionine, la phénylalanine, la thréonine, le tryptophane et la valine. Il peut également arriver, dans des circonstances particulières, que notre corps ait besoin d’un apport alimentaire suffisant en certains autres acides aminés habituellement considérés comme non essentiels, on dit dès lors qu’ils sont conditionnellement indispensables, par exemple parce que la quantité que nous pouvons en fabriquer est limitée pour certains d’entre eux et que nous ne pouvons donc faire face à des besoins accrus, ou encore quand les voies de synthèse sont immatures (nouveau-né) ou défaillantes. Les acides aminés conditionnellement indispensables sont la cystéine, la taurine, la tyrosine, l’arginine, la glutamine, la proline et la glycine. Toutefois, nous n’envisagerons ici que le cas le plus courant, où seuls les neuf acides aminés essentiels mentionnés précédemment doivent obligatoirement être fournis par l’alimentation.
[/color]
Les protéines d’origine végétale (céréales, légumineuses, fruits et légumes…) ne contiennent généralement pas tous les acides aminés essentiels dans des proportions optimales ou bien sont trop pauvres en protéines pour en être de bonnes sources. Les protéines végétales sont, pour la plupart, carencées en un ou plusieurs acides aminés essentiels, ce qui explique que pour couvrir leurs besoins, les végétariens fassent appel à la complémentation protéique, qui consiste à associer deux aliments dont les profils protéiques se complètent, la richesse de l’une contrecarrant la pauvreté de l’autre en un ou plusieurs acides aminés essentiels, et réciproquement.
Dans le cadre de l’alimentation végétarienne, trois acides aminés essentiels doivent être “surveillés de près” car les aliments d’origine végétale ne les contiennent pas tous en quantité suffisante : il s’agit de la lysine, de la méthionine et du tryptophane.
On a établi une échelle de valeurs permettant de savoir à quel point une protéine ou le contenu protidique d’un aliment se rapproche d’une “protéine idéale” pour couvrir les besoins de l’homme : l’indice chimique (ou index chimique). Toutes les protéines et tous les aliments dont l’indice chimique est supérieur ou égal à 100 permettent de couvrir parfaitement les besoins humains en chacun des 9 acides aminés essentiels. Lorsqu’une protéine est déficiente en un acide aminé essentiel par rapport aux proportions “idéales” fixées pour la protéine de référence, on dit que cet acide aminé est son facteur limitant primaire. Si un deuxième acide aminé essentiel est également présent en quantité insuffisante, c’est le facteur limitant secondaire. Dans leur quasi totalité, les protéines animales n’ont pas de facteur limitant. A l’inverse, presque toutes les protéines végétales ont au moins un facteur limitant (sous-entendu, limitant la qualité de la protéine).
[/color]
Cette protéine idéale pour couvrir les besoins protéiques des êtres humains a été proposée par le comité d’experts de la FAO et de l’OMS en 1989. Il s’agit d’un profil type qui se rapproche assez des protéines de l’oeuf, lesquelles étaient autrefois utilisées comme protéine de référence.
[/color]
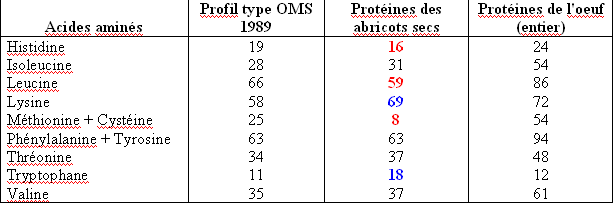
Par exemple : les abricots secs contiennent 4,90 g de protéines aux 100 g. Dans ces 4,90 g de protéines, on trouve 0,08 g d’histidine. La quantité de cet acide aminé exprimée en milligramme par gramme de protéine (mg.g prot-1) est donc de (0,08 / 4,90) * 1000 = 16.
On compare alors le résultat obtenu avec celui correspondant au même acide aminé dans la protéine idéale. Cette valeur est de 19. Nous voyons donc que la teneur en histidine des protéines des abricots secs est inférieure à celle de la protéine idéale. L’histidine est donc un acide aminé limitant (ou facteur limitant) pour les abricots secs. Et l’on procède ainsi pour chacun des acides aminés essentiels.
[/color]
et des protéines de l’abricot sec et de l’oeuf
[/color]
[/color]
Trois acides aminés essentiels ne sont pas présents en proportion suffisante dans l’abricot sec par rapport à la “protéine idéale”. Ces 3 acides aminés limitants sont l’histidine, la leucine et l’association méthionine + cystéine. C’est cette dernière qui fait le plus cruellement défaut aux protéines de l’abricot sec par rapport à nos besoins. Cela signifie que notre organisme ne pourra utiliser les protéines de l’abricot sec que d’une façon très incomplète : une grande partie de ces protéines seront gâchées si l’on ne fait pas appel à la complémentation pour apporter les acides aminés manquants… A défaut de complémentation protéique, on se trouve alors face à deux cas de figure :
soit on absorbe la quantité quotidienne conseillée de protéines mais comme celles-ci ne sont pas de bonne qualité on ne couvrira pas ses besoins en acides aminés essentiels, ni par conséquent ses besoins en protéines ;
soit on mange davantage de cet aliment déficient pour avoir suffisamment de chacun des acides aminés essentiels, mais on se retrouve avec un surplus d’acides aminés qui sont des déchets dont l’excès est nocif pour la santé…
Le facteur limitant primaire de l’abricot sec est Méthionine + Cystéine car c’est lui qui est le moins bien représenté par rapport à la protéine de référence. Comment sait-on que cet acide aminé est le facteur limitant primaire ? Il suffit de calculer, pour chaque acide aminé essentiel, le rapport acide aminé dans l’aliment test / acide aminé dans la protéine de référence et de prendre le plus faible. Dans le cas de l’abricot sec, ce ratio pour méthionine + cystéine est égal à 8 / 25 = 0,32. On exprimera ce résultat sous forme de pourcentage : nous lisons donc ” 32 % “. Les protéines de l’abricot sec ne seront utilisées dans notre organisme qu’à hauteur de 32%. Le reste est perdu. Cette valeur, 32, est celle de l’indice chimique. On voit qu’elle est très éloignée de 100, ce qui témoigne d’une valeur biologique très faible en ce qui concerne les protéines de l’aliment testé. Compte tenu de la définition de l’indice chimique, celui-ci n’est pas censé atteindre une valeur supérieure à 100… Cette limite est toutefois remise en cause par les experts car les valeurs supérieures à 100 fournissent des renseignements fort utiles dans le cadre de la complémentation protéique, c’est pourquoi, dans ce document, ces valeurs supérieures à 100 sont mentionnées au titre de l’indice chimique des aliments concernés, élargissant ainsi cette notion dont la définition et le mode de calcul sont appelés à être révisés d’ici peu.
Tous les acides aminés présents dans l’abricot sec qui apparaissent en rouge dans le tableau sont ses facteurs limitants. L’abricot sec n’est donc pas une bonne source de protéines… En revanche, si l’on observe la colonne des acides aminés présents dans les protéines de l’oeuf, on constate que toutes les valeurs sont supérieures ou égales à celles de la protéine de référence. L’oeuf n’a donc aucun acide aminé limitant et couvre parfaitement bien nos besoins protéiques.
Intéressons-nous maintenant à un “point fort” observable dans la colonne consacrée à l’abricot sec : ses protéines sont riches en lysine (valeur en bleu dans le tableau, égale à 119 % de la teneur en lysine du profil type) or nous savons que certains aliments sont déficients en lysine, en particulier le groupe des céréales. On découvre ainsi que l’abricot sec pourra complémenter les protéines du blé par exemple. Les protéines de l’abricot sec sont également riches en tryptophane, avec 164% de la teneur idéale ! L’abricot sec pourra donc également compléter les protéines du maïs qui sont à la fois déficientes en lysine et en tryptophane… Pour clore cet exemple consacré aux abricots secs, nous signalerons donc que c’est un aliment qui peut être utile dans la complémentation protéique, mais son taux de protéines assez moyen (4,9 %) et ses différents acides aminés limitants ne font pas de lui le meilleur choix. On verra plus loin que la meilleure complémentation aux protéines des céréales défaillantes en lysine sont les légumes secs (haricots secs, pois chiches, lentilles, etc.) et, bien évidemment, les oeufs et les laitages !
L’oeuf, ayant pour sa part des teneurs en acides aminés essentiels élevées voire très élevées (tableau I, colonne de droite), est toujours un aliment utile et efficace pour complémenter aussi bien les protéines des céréales déficientes en lysine, que celles des légumes secs déficientes en acides aminés soufrés (méthionine et cystéine). Il en va de même pour les laitages.
Aliments riches ou pauvres en protéines, que faut-il en penser ?
Aliments riches en protéines : leur teneur en protéines est élevée (10% ou plus). Ils permettent un apport protéique plus ou moins satisfaisant (selon leur indice chimique et leur digestibilité, notion que nous ne développerons pas ici, qui prend en considération l’efficacité de la digestion des protéines de l’aliment étudié et permet d’établir l’index DI-SCO – Protein digestibility corrected amino acid score – de cet aliment), sous un faible volume d’aliment.
Aliments moyennement riches en protéines : leur teneur en protéines est comprise entre 2 et 10%. Moins riches en protéines que les précédents, ils sont cependant très intéressants s’il s’agit d’aliments que l’on consomme en plus grande quantité. Par exemple, une portion de fromage moyenne est généralement de l’ordre de 30 à 40 grammes. En revanche, on peut aisément consommer 250 grammes de légumes au cours d’un repas. Par conséquent, un légume 6 ou 7 fois moins riche en protéines qu’un fromage peut s’avérer être une source de protéines non négligeable ! On notera toutefois que les légumes verts ayant un taux de protéines supérieur à 2% sont relativement peu nombreux.
Aliments pauvres en protéines : leur teneur en protéines est inférieure à 2%. Leur apport protéique sert d’appoint. Il serait illusoire d’espérer couvrir ses besoins protéiques en faisant des orgies de haricots verts, de varech ou de tapioca !
Certains compléments alimentaires sont très riches en protéines (25% ou davantage) mais on ne peut les consommer qu’en petites quantités, une consommation excessive ayant des effets indésirables (par exemple, ne jamais consommer plus de 30 g de levure alimentaire par 24 heures, car celle-ci étant très riche en purines augmente l’uricémie et, donc, le risque de crises de goutte…). Les compléments alimentaires sont toujours assortis de conseils relatifs aux quantités à consommer : respectez les indications du fabricant. On fait appel à des compléments alimentaires riches en protéines au cas où la ration protéique est insuffisante. Leur usage n’est pas obligatoire, une alimentation ovolactovégétarienne diversifiée et suffisante permettant tout à fait de couvrir ses besoins protéiques
[/COLOR]

 Mécanismes de l’ancrage à la membrane (coté cytoplasmique)
Mécanismes de l’ancrage à la membrane (coté cytoplasmique)
 Le passage par le RErugueux : modification co-traductionnelle et repliement des protéines
Le passage par le RErugueux : modification co-traductionnelle et repliement des protéines
