بارك الله فيك
التحميل جار

بارك الله فيك
التحميل جار

بارك الله فيك
التحميل جار

و الآن لنعد إلى الجاذبية الأرضية .. هل تساءلت يوما ما هو مصدر جاذبية الأرض ؟! .
للإجابة على هذا التساؤل ” المهم ” علينا أن نحزم أمتعنا و نقوم بجولة إلى باطن الأرض .. يتكون الغلاف الصخري للأرض من طبقات أولها القشرة الأرضية ، و تليها طبقة الفوتوسفير ثم الكروموسفير أين توجد ملايين الأطنان من المعادن ( الفلزات ) و الصخور المنصهرة ، كل ذلك يدور حول اللب و هو كرة صلبة تقع في مركز الأرض .
نعلم من دراستنا للكهرومغناطيسية أن هناك علاقة وطيدة بين التيارات الكهربائية و المجالات المغناطيسية ، و هذه العلاقة وضحها لأول مرة الفيزيائي الدانمركي ” أورستــد ” عام 1827 في قانونه الشهير الذي ينص على ما يلي :
” عندما يمر تيار كهربائي في موصل مـا فإنه يولد به مجالا مغناطيسيا تتعلق جهته و شدته بجهة و شدة التيار المــار ” .
 الشكل (1-32): البوكسيت؛ أهم خامات الألومنيومالألومنيوم
الشكل (1-32): البوكسيت؛ أهم خامات الألومنيومالألومنيوم إذا علمت أن ذرية الألومنيوم هي 3، والحديد أيضاً 3، السليكون 4، اكتب صيغاً كيميائية لأكاسيد هذه العناصر.
وأولى مراحل تحضير الألومنيوم من هذا الخام هي إزالة الشوائب والحصول على الألومينا بشكل نقي نسبياً. وتستخدم لأجل ذلك تفاعلات كيميائية تشمل المعالجة بهيدروكسيد الصوديوم.
أما المرحلة الثانية لتحضير الألومنيوم فهي التحليل الكهربائي لمصهور الألومينا، وهي طريقة مكلفة جداً؛ إذ تستهلك فيها طاقة كبيرة في مجالين: أولاً صهر الألومينا وثانياً إنتاج الكهرباء للتحليل الكهربائي، وقد أمكن تخفيض الكلفة نسبياً بخفض درجة الانصهار، وذلك بإضافة مواد أخرى للألومينا؛ – كما درست سابقاً- وهي الكريوليت وفلوريد الألومنيوم. ويبيّن المخطط في الشكل (1-33) عمليات استخلاص الألومنيوم من خام البوكسيت.

الشكل (1-33): مخطط استخلاص الألومنيوم من خام البوكسيت.
وهذه الطريقة مكلفة مما ينعكس على ثمن الألومنيوم، فقد وجد أن إنتاج طن من الألومنيوم يحتاج إلى (4.6) طن من خام البوكسيت، (0.5) طن وقود، 0.1 طن NaOH، ا0.04 طن AIF 3،ا 0.3 طن كريولايت، علاوة على ثمن الكهرباء وتآكل أقطاب الكربون التي تحتاج إلى تجديد.
الشيدية
أواسط الأردن
الرصيفة
شمال الأردن
يحتوي الفوسفات الأردني على نسب متفاوتة من الفلوريد كما في الجدول، وفي صناعة الأسمدة الفوسفاتية يضاف حمض الكبريتيك إلى فوسفات الكالسيوم (الذي يحوي الفلوريد)؛ مما يؤدي إلى تكون حمض الهيدروفلوريك، ويمكن مفاعلة الحمض الأخير مع السليكا (SiO 2) لإنتاج حمض الهيدروفلورسيلسيك (H 2SiF 6) الذي يستخدم في تحضير فلوريد الألومنيوم (AIF 3) كما يستخدم في تحضير الألومنيوم.
وقد شجّعت كلفة إنتاج الألومنيوم العالية محاولات جمع الألومنيوم المستخدم وإعادة تجهيزه واستخدامه؛ فكلفة إعادة التجهيز لا تتجاوز 5% من كلفة التحضير من الخامة الأساسية.
اذكر خمسة أشياء يُتوقع وجودها في المنازل ويدخل الألومنيوم في صناعتها. صف هذه الأشياء من جهة ليونتها ومتانتها، وخفتها بالنسبة إلى مثيلاتها من الحديد أو النحاس.
يتوقع وجود صلة بين صفات الألومنيوم واستخداماته. تعرّف صفات الألومنيوم المدرجة أدناه وقارنها بصفات المغنيسيوم التي وردت سابقاً.
ذرة الألومنيوم :العدد الذري: 13، الكتلة الذرية 26.98، إلكترونات مستوى الطاقة الأخير: 3، المجموعة IIIA، الذرية3، رقم مستوى الطاقة الأخير: 3.
عنصر الألومنيوم :الكثافة: 2.70غ/سم3. درجة الانصهار: 660°س. فلز فضي لامع، قابل للطرق والسحب، غير سام، موصل جيد للحرارة والكهرباء، متين، مظهره جذاب.
أذكر ميزتين يتفوق فيهما الألومنيوم على النحاس في مجال صناعة الأسلاك الكهربائية.
ب-طاقة ينتجها الألومنيوم: درست سابقاً أن تفاعل الثرميت ينتزع فيه الألومنيوم الأكسجين من أكسيد الحديد (III)؛ مطلقاً كمية كبيرة من الحرارة ومنتجاً الحديد على شكل مصهور قد تصل درجة حرارته قرابة °3000س. ويوظف هذا التفاعل لعمليات وصل القضبان الحديدية كسكة الحديد.
اكتب معادلة تمثل تفاعل الثرميت مبيناً الطاقة فيها.
وأبرز استخدام حديث للطاقة الناتجة من أكسدة الألومنيوم هو في الوقود الصلب المستخدم في دفع الصواريخ الحاملة للمكوك الفضائي، فأحد أنواع الوقود الصلب المستخدم مكون من : مسحوق الألومنيوم (الوقود)، وفوق كلورات الأمونيوم NH 4CIO 4(المادة المؤكسدة)، وقليل من أكسيد الحديد (III) (لحفز التفاعل)، وصمغ بلاستيكي (لربط المواد ببعضها). وعندما يُشغّل الصاروخ يتأكسد الألومنيوم ويعطي كمية هائلة من الحرارة، فتتمدّد الغازات وتدفع الصاروخ بقوة كبيرة، ويخرج أكسيد الألومنيوم كغيمة بيضاء كثيفة من مؤخرة الصاروخ؛ انظر الشكل (1-34).

جـ-استخدامات لبعض مركبات الألومنيوم: فضلاً عن الاستخدامات السابقة لعنصر الألومنيوم، فإن مركباته تعمل في خدمة الإنسان، وفيما يأتي بعض الأمثلة:
من أبـرز مركبات الألومنـيوم أكسيـده المعروف بالألومـينا، ولإحدى تشـكيلاته الطبيعـية المعروفة بشكل ألف

ا (Al 2O 3) استخدامات مباشرة؛ فهذا النوع من الألومينا يتميز بالقساوة وارتفاع درجة الانصهار (قرابة °2050س)، ومقاومته للتفاعلات، لذا يُصنع منه الطوب الحراري المستخدم في تبطين الأفران، كما يصنع منه ورق الزجاج الذي يستخدمه النّجارون والحدّادون، ويدخل في تركيب بعض الأحجار الكريمة، كما في شكل (1-35)، وفي تركيب الأسمنت.
ومن مركبات الألومنـيوم أيـضاً كبريتات الألومنيوم Al 2(SO 4) 3 المستخدمة في صناعة الورق؛ وتنقية الماء؛ ؟إذ يتكون راسب هيدروكسيد الألومنيوم الجيلاتيني عند إضافة قاعدة مثل: Ca(OH) 2؛ ويحمل الراسب معه الكثير من الشوائب الموجودة في الماء.

وتدخل كبريتات الألومنيوم في تركيب الشب (Alum) مثل شب الألومنيوم البوتاسي KAI(SO 4) 2.12H 2O المستخدم في تثبيت الأصباغ.
2- الكبريت
يوجد الكبريت إما منفرداً أو متحداً مع غيره في مركبات طبيعية غير عضوية منها: كبريتات الفلزات الحاوية على أيون الكبريتات i(SO4) 2- وكبريتيداتها الحاوية على أيــون الكبريتي S 2-i، وفي مركبات عضوية كالنفط وفي مكونات بعض الخضراوات (كالثوم والبصل).
اذكر مثالين على مركبات الكبريتات ومركبات الكبريتيد.
ويوجد في القشرة الأرضية منفرداً (غير متحد مع عناصر أخرى)؛ وكان – قبل عقود- المصدر الرئيس للعنصر ولمركباته المستخدمة، إلاّ أن الكبريت المتحد الموجود في المنتوجات النفطية (الغاز الطبيعي والبترول)، أصبح يأخذ حصة متزايدة في إنتاج الكبريت؛ فأكثر من 60% من الكبريت يأتي الآن من المصادر النفطية.

ويمكن الحصول على الكبريت المنفرد من الأرض بطريقة فراش كما في الشكل (1-36)؛ إذ يتم صهر الكبريت في مكان وجوده باستخدام الماء الحار المضغوط ودفعه مصهوراً إلى سطح الأرض باستخدام الهواء المضغوط.
وفي الوقت الحاضر تزايد الاهتمام باستخلاص الكبريت من المنتوجات النفطية مثل الغاز الطبيعي حيث يوجد الكبريت في الغاز الطبيعي على شكل كبريتيد الهيدروجين H 2S، ويُفصل بوساطة مذيبات خاصة ثم يفصل من المذيبات ويُفاعل مع كمية محدودة من الأكسجين (احتراق غير كامل) منتجاً الكبريت.
إن إزالة الكبريت من النفط عند تكريره أمر لابد منه سواء قُصد تحضير الكبريت أم لا، فبقاء الكبريت في الغاز الطبيعي أو في النفط السائل يؤدي عند الاحتراق إلى تكون غاز SO 2 الذي درست سابقاً عن أثره الضار في البيئة (المطر الحمضي كما أنه يؤدي إلى تآكل آلات الاحتراق)؛ لذا أصبح إنتاج الكبريت ملازماً لصناعة النفط.
النشاط (1-13): بعض خصائص الكبريت
ارجع إلى الجدول الدوري وإلى مرجع (Handbook of Chemistry & Physics)، وسجّل صفات الكبريت المشار إليها في الجدول الآتي:
الدورةالمجموعة
* ستجد أكثر من قيمة. سجل جميع القيم.
بعد اطّلاعك على الصفات المبينة في الجدول، ومقارنتها بصفات عناصر أخرى، قد تتولد لديك تساؤلات منها: ما سبب تعدّد درجات الانصهار وقيم الكثافة المسجلة للكبريت؟
من المتوقع أن تجد إجابات عن هذه الأسئلة بعد دراستك عن تركيب عنصر الكبريت وسلوكه. ومن أبرز صفاته التي تفسر سلوكه – صفة التآصل (Allotropy).
أ-
التآصل: هناك عدد من العناصر عندما تتجمع دقائقها (ذراتها أو جزيئاتها) في احلاله الصلبة فإنها تعطي أشكالاً مختلفة، تتفاوت في انتظام بلوراتها، وفي ترتيبها؛ فقد تتجمع دقائق مادة ما في شكل بلورات مكعبة أو معينية أو كروية- وذلك حسب ظروف تكوينها (الضغط ودرجة الحرارة) – ويمكن تشبيه ذلك بالأشكال المختلفة التي يمكنك بناؤها مع قطع الليغو نفسها.
ولعنصر الكبريت الصلب أكثر من شكل تآصلي؛ فهو – في القشرة الأرضية- ذو لون أصفر، وقد بيّنت الدراسات أنه مكون من جزئيات يحتوي كل منها على ثماني ذرات S 8 متصلة ببعضها في حلقة تشبه شكل التاج، الشكل (1-37) وتتجمع هذه الجزئيات في بناء هندسي منتظم في بلورة الكبريت المعيني شكل (1-38).
وإذا صُهر الكبريت وسُخِّن إلى درجـة حرارة تـزيد قليلاً على 120س° ثم يُرّد ببطء فإن البلورات تأخذ الشكل الإبري أحادي الميل المختلف عن الشكل العيني، لاحظ الشكل (1-39)، لكنها تتكون من جزئيات S 8 نفسها التي يتكون منها الكبريت المعيني.
لعلك تستنتج أن ظاهرة التآصل هي السبب في وجود أكثر من درجة انصهار للكبريت وأكثر من قيمة للكثافة.
 الشكل (1-37): جزيء الكبريت الحلقي S 8.
الشكل (1-37): جزيء الكبريت الحلقي S 8.
 الشكل (1-38): الكبريت المعيني.
الشكل (1-38): الكبريت المعيني.
 الشكل (1-39): الكبريت الإبري.
الشكل (1-39): الكبريت الإبري.
الغرافيت والماس من الأشكال التآصلية للكربون، وهي ليست أشكالاً نقية، إذ تحتوي على ذرات عناصر أخرى غير الكربون. وقد اكتشف حديثاً شكل نقي للكربون يتكون من جزئيات كربونية عملاقة. ويتكون جزئ الكربون العملاق من 60 ذرة كربون (C 60) ويسمى بكمنستر فوليرين (Buckminster Fullerene) نسبة إلى مكتشفه الأمريكي. ويطلق الكيميائيون على الجزيء الجديد كرة باكي (Bucky Ball)، إذ أنه على شكل كرة مفرّغة.

وقد تمكن الكيميائيون في عام 1991م من التقاط صورة لجزيء كرة باكي بوساطة الأشعة السينية وبمساعدة الحاسوب. وتبيّن من تركيبه البلوري كيفية ترتيب الـ 60 ذرة كربون والتركيبات الخماسية والسداسية المتجاورة، كما تأكد شكله الهندسي الكروي الذي يشبه القبة، انظر إلى الشكل المجاور. ويمكن الحصول على كرات باكي بتسخين قطعة من البرافين باستخدام لهب بنسن؛ إذ يتكون سناج أسود يحتوي على كرات باكي. وقد وجد أن جزئيات C60 أكثر مرونة من أي جزئيات أخرى معروفة، وهذه الخاصية تجعلها صالحة للاستخدام وقوداً للصواريخ ومرْكبات الفضاء إذ يمكنها أن تتحمل ضغوطاً هائلة. وإذا ضُغطت كرات باكي باتجاه بعضها البعض، فإن ذرات الكربون في الكرات المتجاورة تبدأ بالتنافر وتصبح المادة شديدة الصلابة، وإذا زاد الضغط بسرعة هائلة وبقوة تتحول كرات باكي إلى الماس.
وقد وجد العلماء أن تبريد خليط من كرات باكي والبوتاسيوم أو أي مواد أخرى، إلى درجة حرارة منخفضة – °255س، يصبح للخليط مقدرة فائقة على توصيل التيار الكهربائي ويواصل العلماء البحث عن تطبيقات عملية مفيدة أخرى لهذا الجزيء العجيب.
النشاط (1-14): التآصل في الكربون
يوجد للكربون شكلان تآصليان هما الماس والغرافيت ارجع إلى كتاب Handbook of Chemistry & Physics وسجّل المعلومات الآتية عنهما:
أ- اللون. ب- درجة الانصهار جـ- الصلابة د- التوصيل الكهربائي
ب-استخدامات الكبريت: مثل كثير من اللافلزات؛ تؤدي الاستخدامات المباشرة لعنصر الكبريت إلى استهلاكه، ويستخدم الكبريت المنفرد في صناعة البارود والمفرقعات. ومنذ القدم استخدم الكبريت في صنع أعواد الثقاب؛ فهو أحد مكونات المادة التي توضع على رأس العود، ومن هنا جاء الاسم الشائع لعود الثقاب وهو: عود “الكبريت”. وقد عرفت خاصية الاشتعال في الكبريت منذ اكتشافه فسمي حجر الاحتراق.

ومن استخداماته التي لا تشمل اشتعاله – مكافحة الفطريات والحشرات التي تصيب النباتات.
ويقترن الكبريت واستخدامه بأهم مادة كيميائية تستخدم في مختلف مجالات الحياة، من صناعة وزراعة وغيرها – وهي حمض الكبـريتيك (H 2SO 4)، ولا شك أنك تعرفت هذا الحمض في مجال دراستك عن الحموض وتفاعلاتها، والأمثلة على تفاعلاته عديدة، ولا تكاد تستغني عنه أي صناعة مهمة، ولا يكاد يخلو منه مختبر.
وتُحضّر منه سنوياً عشرات الملايين من الأطنان، ويعد الازدياد في استهلاكه مؤشراً على التقدم الصناعي، ويمثل الشكل (1-40) نسب استخدامه في بعض المجالات الصناعية الرئيسة التي تتصدرها صناعة الأسمدة. مثل: سماد كبريتات الأمونيوم i(NH 4) 2SO 4 ، وكبريتات البوتاسيوم K 2SO 4والسوبرفوسفات.
ويستخدم غاز ثاني أكسيد الكبريت (SO 2) (الذي عرفته غازاً ضاراً للبيئة والكائنات الحية) في صناعة الورق والأقمشة، إذ يقصر الألوان ويستخدم كمادة حافظة لكثير من المواد الغذائية، كالعصير ورقائق البطاطا.
وللكبريت مركب آخر دخل بيوتنا – في أكثر الأجهزة انتشاراً- وهو كبريتيد الخارصين ZnS، الذي – لولاه- لما رأينا صورة على شاشة التلفاز؛ إذ تصنع منه الطبقة التي تغطي زجاج الشاشة، وتتكون الصورة نتيجة سقوط الأشعة عليها.
النشاط (1-15): معلومات عن العناصر
اختر عنصراً من عناصر مجموعة A في الجدول الدوري غير المذكور في هذا الفصل، ثم اختر واحداً من مركباته الرئيسة وسجّل معلومات عن العنصر وعن المركب تشمل الجوانب الآتية:
أ- موقع العنصر في الجدول الدوري، وصفات ذراته.
ب- صفات العنصر الطبيعية والاستخدامات المتصلة بها.
جـ- المصدر الذي يحضر منه العنصر.
د- الطريقة العامة لتحضير العنصر.
هـ-أبرز صفات المركب.
و-أبرز استخدامات المركب.
ز- طريقة لتحضير المركب.
قدم عملك لمدرسك ليجمعه وينسقه مع أعمال زملائك في لوحة تعرض في المدرسة. استعن بالمعلومات الواردة في هذا الفصل وبالمراجع التي أصبحت معروفة لديك. اجمع صوراً ورسوماً توضح صفات العنصر واستخداماته.
عصيدة الزقوقو..  حصريا في..
حصريا في..

أهديها إلي كل أعضاء منتدي اللمة الجزائرية و زوارها
رجاء خاص : هذه الوصفة مطلوبة جدا.. ونادرة أرجو من المشرفين تثبيتها .
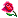
ماهو الزقوقو ؟: هو بذور يميل لونها الى السواد مستخرجة من أأشجار الصنوبر البري . (Le pin d’Alep
والجدير بالذكر ان منطقة المغرب العربي تزخر غاباتها بهذا النوع من الأشجار إلا ان تونس هي البلد الوحيد الذي يستغلها في اعداد وصفة "عصيدة الزقوقو"

المقـــــادير :
لتحضير العصيدة
500غ زقوقو
350غ فارينة (دقيق)
400غ سكر مرحي
حكة حليب نستلي (علبة حليب مركز حلوة المذاق)
لتحضير الكريمة: la Crème patissiere
2 باكو(قرطاس) كريمة بنكهة الموز أو الفزدق أو الفانيليا
1 لتر من الحليب
10 ملاعق كبيرة من السكر(السكر حسب الذوق)
وفي صورة عدم توفرها في بعض البلدان العربية اصنعوها بواسطة مزج الحليب والسكر والنشاء وأصفر البيض .
للزينة :
لوز – قنفيد أو الدراجي-(حلويات ملونة يوجد بداخلها اللوز)- بندق-(صنوبر)- فزدق –(فستق)-بوفريوة- جوز(عين الجمل/قرقاع) – دنيا وحلويات مثل الشعرية ألوانها زاهية .
طريقة التحضير :
ينقى الزقوقو ويغسل ثم نحمصه قليلا فوق النار حتى نشم رائحته (يجب أن لا يحترق).
ثم يعجن في آلة لفرم اللحم (عجانة اللحم) مع اضافة القليل من الماء حتى نتحصل على عجينة.
نأخذ العجينة ونحلها في الماء وندلك جيدا بأيدينا لنتخرج خلاصته.
يصفى خليط الماء والزقوقو بأدق مصفاة (أو أي قطعة من القماش تكون ثقوبها صغيرة جدا مثل "الليبا") بحيث لا تبقى منه الا القشور.
نأخذ هذا الخليط ونضيف اليه نصف كمية الفارينة (دقيق) والسكر ونخلطها حتى يذوب السكر أو نضعها قليلا في الخلاط.
ثم نضعها على النار ونحركها باستمرار في شكل دائري (لا تكفي عن التحريك )
نضيف الكمية الباقية من السكر والفارينة تدريجيا.
وعندما تصل الى درجة الغليان وتخثر العصيدة(تقريبا ساعة من بداية الطبخ) ترفع من على النار.
ونضيف اليها علبة الحليب المركز وماء العطرشية أو أي نكهة أخرى ونضعها في الثلاجة في التبريد العادي لليلة كاملة.

المرحلة النهائية …
نخرج عصيدة الزقوقو التي أحضرنا قبل ليلة من الثلاجة ثم نضيف اليها الكريمة التي يجب ان لا تكون ساخنة جدا حتى لا تفسد العصيدة ولا تغرق فيها.
يسلق اللوز في الماء ثم يقشر ويحمص . كما تحمص جميع انواع الفواكه الجافة(المكسرات) ويرحى (يطحن) جزء منها ويحتفظ بالباقي على حالته للتزيين .

تتبادل السيدات التونسيات "عصيدة الزقوقو" في ما بين العائلات ويتنافسن حول من عصيدتها الألذ والأجمل … لخلق جو من المرح…
لخلق جو من المرح… في يوم المولد النبوي الشريف .
في يوم المولد النبوي الشريف .

 ولكن لذتها تستحق منا كل هذا العناء ..فجربوها..وادعوا لي..
ولكن لذتها تستحق منا كل هذا العناء ..فجربوها..وادعوا لي..