وفي هذا الدرس سنتعرف على بعض المواد الاساسية الموجودة في جسم الكائن الحي ودورها في عملية البناء , والتفاعلات اللازمة لتزويد الجسم بما يحتاج من طاقة .
ومن هذه المواد :
1- الكربوهيدرات .
2- الليبيدات .
3- البروتينات .
وسنتناول كل منها بالتفصيل الممتع 
بعد دراسة هذا الدرس يتوقع ان تكون قادراً على ان :
1- تذكر ثلاثة انواع من المواد التي تزود الجسم بما يحتاج اليه من طاقة .
2- تكتب الصيغة العامة للكربوهيدرات .
3-تميز بين السكريات الاحادية والثنائية والعديدة .
4- تكتب الصيغة البنائية لمركبات الكربوهيدرات الاحادية والثنائية .
5- تذكر مثال على السكريات الاحادية والثنائية والمتعددة .
الكربوهيدرات :
هي مركبات كيميائية عضوية تتكون من الكربون , والهيدروجين , والاكسجين . وتعتبر هذه المركبات من مصادر الطاقة في جسم الكائن الحي, والمادة التركيبية لعضيات الخلية .
الصيغة العامة : x [CH2O]n , حيث n = من 3 الى 7 .
صور الكربوهيدرات : توجد على هيئة سكريات , ونشويات , وسكريات بسيطة , وكربوهيدرات بسيطة ومعقدة , ودايت كربوهيدرات .
المصادر الغذائية للكربوهيدرات :
1. تعتبر السكريات المعقدة مصادر جيدة للمعادن والفيتامينات والألياف والتي نستطيع الحصول عليها من :
§ الخبز .
§ الحبوب .
§ بعض الخضروات .
§ الارز .
§ البطاطس .
2. السكريات البسيطة ايضا تحتوي على المعادن والفيتامينات ونحصل عليها من :
§ الفواكه .
§ الحليب ومنتجاته .
§ الخضروات .

وظيفة الكربوهيدرات :
الوظيفة الأساسية للكربوهيدرات هو توفير الطاقة لجسم الكائن الحي خاصة الدماغ والجهاز العصبي.حيث يتم تحويل النشا والسكر الى جلوكوز ومن ثم يتاكسد الجلوكوز ويتحول الى طاقة . مثلا واحد مول من الجلوكوز ينتج عند اكسدته طاقة مقدارها 673 كيلوكالاري ( الكالاري كمية الطاقة اللازمة لرفع درجة حرارة كيلوجرام من الماء درجة سيليزية واحدة ) .
المجموعات الوظيفية التي تدخل في تركيب الكربوهيدرات :
تعتبر الكربوهيدرات الديهيدات أي انها تحتوي على مجموعة الديهيد .
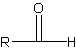
او كيتونات عديدة الهيدروكسيل.
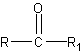
بعضها تحتوي على مجموعات حرة للكيتون والالديهيد , وبعضها لا يحتوي على أي منها ولكن عند تحلله في الماء يعطي مركبات تحتوي اما على كيتون او الديهيد .
ويمكن تقسيم الكربوهيدرات تبعا لعدد جزيئات السكر بها الى الاقسام التالية :
§ سكريات احادية ( Monosaccharides ) : وهي ابسط انواع السكريات تتكون من جزيء واحد فقط , وكل جزيء يحتوي على 3 – 7 ذرات كربون .
امثلة : الجلوكوز (C6H12O6) , و الفركتوز (C6H12O6) , والرايبوز (C5H10O5) .
التصنيف : تصنف السكريات الاحادية على اساس عدد ذرات الكربون ونوع المجموعة الوظيفية في الجزيء. مثلا لدينا الجلوكوز والفركتوز لهما نفس الصيغة الجزيئية (C6H12O6) , أي انهما يحتويان على نفس عدد ذرات الكربون الا ان المجموعة الوظيفية في الجلوكوز هي الالديهيد , وفي الفركتوز هي الكيتون. اما بالنسبة للريبوز فان الفرق يكون في عدد ذرات الكربون .
جميع السكريات الاحادية تكون على خطية , حيث ان جميع ذرات الكربون في السلسلة ما عدا واحدة تكون مرتبطة بمجموعة هيدروكسيل (-OH ) , اما الاخيرة تكون مرتبطة بمجموعة الكربونيل (-C=O ) .

السكريات الاحادية التي تحتوي على عدد من ذرات الكربون يساوي خمس او اكثر قد تكون على هيئة حلقات بالاضافة الى الشكل الخطي كما هو موضح في الصور التالية :



في هذا المركب تتكون رابطة تساهمية بين مجموعة الالديهيد في ذرة الكربون الاولى , ومجموعة الهيدروكسيل المرتبطة بذرة الكربون الخامسة :

كما هو واضح في الصورة فان الجلوكوز يكون على صورتين , الفا وبيتا. ويكون للجلوكوز طبيعتين في المحاليل المائية فقط , والاختلاف يكون في موقع احد مجموعات الهيدروكسيل .

الفركتوز

في هذا المركب تتكون رابطة تساهمية بين مجموعة الالديهيد في ذرة الكربون الثانية , ومجموعة الهيدروكسيل المرتبطة بذرة الكربون الخامسة :

§ سكريات ثنائية : تتكون من ارتباط جزيئين من السكريات الاحادية برابطة كيميائية تساهمية . ويتحلل الجزيء الواحد فيها مائيا ليعطي جزيئين من السكريات الاحادية .
امثلة : السكروز ( سكر القصب ) : يتكون من جزيئين الاول جلوكوز والثاني فركتوز .
اللاكتوز ( سكر الحليب ) : يتكون من جزيئين ايضا الاول سكروز والثاني جلاكتوز .
المالتوز ( سكر الشعير ) : يتكون من جزيئين جلوكوز الفا وبيتا .

صورة توضح تكون المالتوز من جزيئين جلوكوز بعد فقد جزيء ماء وتكون الرابطة التساهمية .

صورة توضح الاكتوز والسكروز .
§ السكريات العديدة ( كربوهيدرات عديدة التسكر ) :
جزيئات كبيرة من الكربوهيدرات يتحلل الجزيء الواحد منها مائيا الى عدة جزيئات من السكريات الاحادية.
امثلة : النشا :
والنشا الطبيعي هو عبارة عن خليط من نوعين احدهما يسمى الاميلوز ( 10-20%) ويوجد هذا النوع في القسم الداخلي للخلية ويتكون من سلسة طويلة غير متفرعة من عدة الاف من جزيئات الجلوكوز ترتبط مع بعضها البعض عن طريق اتصال ذرة الكربون رقم ( 1 ) في الجزيء الاول بذرة الكربون رقم ( 4 ) في الجزيء الذي يليه مع فقد جزيئات ماء , وهو قابل للذوبان في الماء .
والاخريسمى الاميلوبكتين ( 80-90%) ويوجد هذا النوع في جدار الخلية, ويكون غير قابل للذوبان في الماء . وهو عبارة عن متفرعة تتكون من سلسلة رئيسية خطية ترتبط فيها جزيئات الجلوكوز بالارتباط بين ذرة الكربون رقم ( 1 ) في الجزيء الاول بذرة الكربون رقم ( 4 ) في الجزيء الذي يليه مع فقد جزيئات ماء . وتتكون الرابطة بين السلسلة الرئيسية والتفرع بارتباط ذرة الكربون رقم ( 1 ) من التفرع مع ذرة الكربون رقم ( 6 ) من السلسلة الرئيسية . كما هو موضح في الصورة التالية :
الصورة التوضييحية للاميلوبكتين , وهو عبارة عن سلسلة متفرعة :

السيليلوز: يعتبر من اهم المواد التي تدخل في تركيب جدر الخلايا النباتية . وهو المادة الاساسية المكونة لهيكل النباتات . وينتج السيليلوز من تكاثف عدد كبير جدا يقدر بالالاف من جزيئات الجلوكوز عن طريق الارتباكط بنفس الطريقة الواردة في الاميلوز. وهو عبارة عن سلسلة غير متفرعة قد تصل كتلتها الى الملاين .

ويكون السيليلوز الالياف التي تساعد في عملية الهضم في الانسان .

صورة توضح السيليولوز في جدار الخلية النباتية
والجليكوجين : يخزن في الكبد ويتحول الي جلوكوز بفعل هرمون الجلوكاجون في حالة نقص نسبة السكر في الدم
الصورة التوضيحية :