المعادن :
يمكن تعريف المعدن بأنه عبارة عن مادة طبيعية ذات تركيب كيميائي مميز أو متغير في نطاق محدود وله تركيب بلوري داخلي ثابت ويظهر أحياناً على شكل بلورات ويوجد على شكل متبلور في أغلب الأحيان. ويلاحظ من التعريف السابق أن المعدن هو مادة توجد في الطبيعة وليس للإنسان أو الحيوان أو النبات دخل في تكوينها. كما نلاحظ أن التركيب الكيميائي ليس كافياً لتحديد المعدن حيث أنه لا بد أن نعرف التركيب البلوري الذي يتحكم في كثير من الصفات الطبيعية للمعدن مثل الصلابة والمخدش والوزن النوعي واللون. وتوجد المادة الكيميائية على صورة معدن أو أكثر يختلف كل منهما تمام الإختلاف عن الآخر فمثلاً يوجد الكربون في الطبيعة على صورة معدن الألماس وهو أصلب المعادن المعروفة كما يوجد على صورة معدن الجرافيت وهو من أقل المعادن صلابة. وقد تمكن العلماء حتى الآن من وصف أكثر من ألفين معدن مختلف إلا أن جميع المعادن الشائعة التي تدخل في تركيب الصخور وكذلك المعادن الاقتصادية لا تتجاوز مئتي معدن فقط.
الأنظمة البلورية :
توجد المعادن في أشكال بلورية مختلفة والبلورة عبارة عن جسم من وسط صلب متجانس التركيب الكيميائي ويحدها أسطح ومستويات طبيعية تعرف باسم أوجه البلورة وتتميز بوجود علاقات تماثل معينة. ويمكن تقسيم البلورات عادة إلى سبعة نظم بلورية وذلك على أساس أطوال المحاور البلورية أ , ب , ﺟ , والزوايا البلورية α ، β ، γ ، والنظم البلورية السبعة هي:
1– نظام المكعب:
ويمتاز هذا النظام بثلاثة محاور بلورية متساوية ومتعامدة.أي إن:
أ = ب = ﺟ , α = β = γ = 90 ° وتمثل هذا النظام بلورة الألماس.
2 – نظام الرباعي :
ويمتاز هذا النظام بثلاثة محاور بلورية متعامدة، المحوران الأفقيان متساويان والمحور الثالث رأسي وهو أطول وأقصر منهما، أي إن:
أ = ب ≠ ج ، α = β = γ = 90 ° ويمثل هذا النظام الزيركون.
2 – نظام السداسي :
ويمتاز هذا النظام بأربعة محاور بلورية ، ثلاثة منها أفقية ومتساوية ومتبادلة وتتقاطع في زوايا مقدارها120 ° درجة والمحور الرابع رأسي أطول أو أقصر منها وعمودي على مستواها، أي إن:
أ1 = أ 2 = أ 3 ≠ 90 °، γ = 120 ° ويمثل هذا النظام بلورة البيريل.
4 – نظام الثلاثي:
ويمتاز هذا النظام بأربعة محاور بلورية مثل النظام السداسي. وهما متشابهان من حيث عدد
المحاور البلورية وكيفية توزيعها والاختلاف الوحيد بينهما هو أن المحور ( ﺟ ) في النظام الثلاثي
محور تماثل بينما في النظام السداسي محور تماثل سداسي. وتمثل هذا النظام بلورة الكوراندوم.
5 – نظام المعيني القائم :
ويمتاز هذا النظام بثلاثة محاور بلورية غير متساوية ولكنها متعامدة، أي أن:
أ ≠ ب ≠ ﺟ ، γ = β = α = 90 ° وتمثل هذا النظام بلورة الكبريت المعين.
6 – نظام احادي الميل:
ويمتاز هذا النظام بثلاثة محاور غير متساوي والمحور ( ب ) عمودي على مستوى أ ، ﺟ لكن المحور ميل على مستو المحورين ب ، ﺟ ، أي أن:
أ ≠ ب ≠ ﺟ ، γ = α = 90 ° ≠ β ، وتمثل هذا النظام بلورة الأورثوكليز.
7 – نظام ثلاثي الميل:
ويمتاز هذا النظام بثلاثة محاور بلورية غير متساوية وتتقاطع في زوايا غير متساوية أيضاً، أي إن :
أ ≠ ب ≠ ﺟ ، α ≠ β ≠ γ = 90 ° ويمثل هذا النظام بلورة الميكروكلين.
الخواص الطبيعية للمعادن
إن نوع الذرات وترتيبها الداخلي في أي معدن لا يحددان شكله البلوري فقط ولكنهما يحددان أيضاً خواصه الطبيعية والكيميائية والضوئية. ويمكن التعرف على المعادن لإما بواسطة فحصها بالعين المجردة أو إختبارات طبيعية أو كيميائية أو ضوئية. وتعتبر الخواص الطبيعية مهمة جداً للتعرف على المعادن ويمكن تقسيمها إلى التالي :
1- الخواص البصرية:
وهي مجموعة من الخواص التي تعتمد على الضوء مثل اللون والمخدش والشفافية والبريق والتضوء (التفلور والتفسفر).
2- الخواص التماسكية:
وهي مجموعة من الخواص التي تتوقف على مقدار تماسك المعدن مثل الصلابة والانفصام والانفصال والمكسر وكذلك قابلية المعدن للسحب والطرق والتشكيل.
3 – الوزن النوعي :
وتتوقف هذه الخاصية على كيفية رص وترابط جزيئات وذرات المعدن.
4- الخواص الحسية:
وهي مجموعة من الخواص التي تعتمد على الحواس مثل الطعم والملمس والرائحة.
5- الخواص الحرارية:
وهي الخواص التي تعتمد على الحرارة مثل قابلية المعدن للانصهار.
الخواص التي تعتمد على المغناطيسية والكهربائية والنشاط الإشعاعي للمعدن.
الخواص التي تعتمد على الشكل البلوري للمعدن.
وفيما يلي استعراض موجز ومبسط للخواص الطبيعية :
الخواص البصرية: وأهمها ما يلي:
1- اللون:
يعد اللون من الصفات الطبيعية المهمة لتمييز المعادن خارجياً وخاصة في المعادن الفلزية ولكن اللون لا يعد صفة ثايتة للمعادن في أغلب الأحيان ولذلك لا يمكن الاعتماد على اللون لمعرفة المعادن. ويمكن تقسيم المعادن من حيث اللون إلى قسمين: معادن ذات ألوان ثابتة مثل اللون الأزرق لمعدن الأزيورايت واللون الأصفر للذهب والبيريت واللون الأحمر للنحاس. ومعادن ذات ألوان غير ثابتة مثل معدن
الفلوريت الذي يكون غالباً ذا لون أخضر أو أصفر أو لون أبيض أو بني أو قرمزي أو عديم اللون نتيجة لوجود مواد ملونة على هيئة شوائب أو مواد دخيلة، ويتوقف اللون على نوع الضوء الذي يمتصه أو يعكسه المعدن.
2- المخدش:
وهو لون ما مسحوق المعدن الناعم. ويمكن الحصول عليه بواسطة حك المعدن المراد فحصه على السطح غير اللامع بقطعة من الخزف تعرف بلوح المخدش. وتعطي معادن الحديد السوداء اللون مثل الماجناتيت والهيماتيت والألمناتيت مخدشاً مميزاً لكل واحد منهم، فالهيماتيت مخدشه أحمر بينما الماجناتيت أسود بينما الألمناتيت مخدشه محمر. وقد يتشابه لون المخدش مع لون المعدن كما هو الحال في كل من معدني الليمونايت والجرافايت ويلاحظ أن معظم المعادن ذات البريق اللافلزي لها مخدش ذو لون أبيض أو فاتح ولهذا فإن خاصية المخدش ليست بالصفة التي يمكن الاعتماد عليها عند الرغبة في التفريق بين المعادن ذات البريق اللافلزي.
3- الشفافية:
تعتمد هذه الخاصية على قدرة المعدن على إنفاذ الضوء خلاله وتنقسم المعادن من حيث الشفافية إلى ثلاثة أنواع:
أ- معادن الشفافية :
وهي المعادن التي تسمح بمرور معظم الضوء الساقط عليها ويمكن رؤية لأجسام من خلالها بسهولة مثل أنواع الكوارتز والكالسيت.
ب- معادن نصف شفافية:
وهي معادن تنفذ الضوء بكمية أقل من المعادن الشفافة ولا تسمح برؤية الأجسام خلالها مثل معدن الأوبال.
ج- معادن معتمة:
وهي المعادن التي لا تسمح بمرور الضوء حتى من خلال شرائحها الرقيقة مثل معادن الماجنايت والبايرايت والجالينا.
4- البريق:
وهو مظهر سطح المعدن عندما ينعكس عليه الضوء. ويمكن تقسيم المعادن تبعاً لهذه الخاصية لقسمين:
( أ ) معادن ذات بريق فلزي مثل بريق الذهب والبارايت.
(ب) معادن ذات بريق لافلزي.
ويمكن تقسيم البريق اللافلزي إلى أنواع مختلفة أهمها:
البريق الزجاجي : مثل بريق معدن الكوارتز.
البريق الؤلؤي : مثل بريق معدن التلك.
البريق الحريري : مثل بريق معدن الأسبستوس.
البريق الصمغي : مثل بريق معدن السفاليرات والكبريت.
البريق الماسي : مثل بريق معدن الألماس.
البريق الترابي : مثل بريق معدن البوكسايت.
الخواص التماسكية :
وهي الخواص التي تعتمد على قوة ترابط جزيئات المعدن. وتشمل الصلابة والمكسر والانفصام والانفصال ةالتماسكية.
1- الصلابة:
وهي مقدار المقاومة التي يبديها المعدن للخدش وقد اتفق على عشر درجات ثابتة للصلابة تميز كل درجة منها معدناً معيناً، ويشمل هذه الدرجات العشر مقياس عالمي يسمى مقياس قوة الصلابة. ويمكن ترتيب المعادن حيب صلابتها كالتالي:
-1- التلك ; -6- الأرثوكليز
-2- الجبس & -7-الكوارنز
-3- الكالسيت &nbssp; 8-التوباز
-4- الفلورايت &nbbsp; 9- الكوراندم
-5- الأباتايت &nbbsp; 10- الألماس
2- الانفصام:
وهو قابلية بعض المعادن للانفصام أو التشقق عند مستويات معينة منتظمة ومتوازية عند طرقها طرقاً خفيفاً بحيث تكون الأسطح الناتجة عن هذا الانفصام مستوية تقريباً، ويطلق على هذه الأسطح مستويات الانفصام. وترتبط اتجاهات مستويات الانفصام ارتباطاً وثيقاً بالتركيب البلوري للمعدن فتكون هذه المستويات موازية لوجه بلوري معين أو عدة أوجه مميزة في المعدن القابل للانفصام.
– الانفصال:
هي الخاصية التي لا ترتبط بالتركيب البلوري للمعدن عندما يتفتت أو يتكسر إلى أجزاء صغيرة. ذلك لأن تفتت المعدن يكون بسبب مستويات الضعف في المعدن وتنتج هذه المستويات عن عوامل خارجية حدثت للمعدن بعد تبلوره مثل الضغظ والتكسير.
4- المكسر:
وهو عبارة عن الشكل الذي يكون عليه سطح المعدن عند كسره صناعياً في اتجاهات تختلف عن الاتجاهات التي ينفصم المعدن فيها، وهناك عدة أشكال للأسطح المعدنية التي تتعرض للكسر صناعياً مثل المكسر الحراري (معدن الكوارتز) والمكسر الترابي ( معدن الكاولين).
5- التماسكية :
وهي الصفة التي تعتمد على قوة الترابط بين ذرات المعدن وتعرف بأنها مقاومة المعدن للثني أو السحب أو الكسر أو الطحن.
الثقل النوعي:
وتعد هذه الصفة من أهم الصفات الطبيعية للمعدن. ويمثل الثقل النوعي النسبة بين كتلة المعدن زكتلة حجم مساو له من الماء. ويمكن تحديد الثقل النوعي لأي معدن بتطبيق المعادلة التالية:
الثقل النوعي للمعدن = ﻫ
ﻫ – ﻫ 1
حيث إن ﻫ = وزن المعدن في الهواء
ﻫ 1 = وزن المعدن في الماء
ويمكن تسيم المعادلة من ناحية الثقل النوعي إلى : خفيف مثل معدن الجرافيت ( 2,2 ). متوسط مثل معدن الكوارتز ( 3,6 ). وثقيل مثل معدن البارايت ( 4,5 ). وثقيل جداً مثل معدن الجالينا ( 7,6 ).
الاشعاع الذري:
تمتاز بعض المعادن بإطلاق إشعاعات نتيجة للتحلل الذاتي لذراتها ويمكن الكشف عن هذا الاشعاع بواسطة أجهزة خاصة مثل عداد جايجر ومن أهم المعادن المشعة اليورانينايت والثورايت والمونازايت والبتشلبلند.
المغناطيسية:
وهي الخاصية التي تجعل بعض المعادن تتأثر بالمغناطيس مثل معدن الماجنتايت والبيروهوتايت. بينما لا تتأثر بعض المعادن بذلك إطلاقاً مثل معدن الكوارتز وغيره من المعادن.
الخواص الكهربائية:
تتميز بعض المعادن مثل التوباز والكبريت بأن لها قابلية لأخذ شحنات كهربائية عندما تتعرض للاحتكاك أو دلكها بقطعة من الحرير حيث تلتقط قصاصات الورق أو قطع صغيرة من القش. ويتم فصل المعادن القابلة للتكهرب من المعادن العديمة القابلية بطريقة الفصل الكهروستاتيكي.
الانصهارية :
ويمكن أن تساعد هذه الخاصية في التعرف على المعادن حيث أن معظم المعادن لها درجات انصهار ثابتة إذا كانت نقية فالذهب ينصهر عند 1062 °م بينما تنصهر الفضة عند 960 °م .. إلخ.
الخواص الحسية:
1- الرائحة:
تتميز بعض المعادن برائحة خاصة عندما تتعرض للاحتكاك أو التسخين أو التنفس عليها مثل:
أ- رائحة طينية: وهي الرائحة التي تنتج عند وضع الماء على معدن الكاولين.
ب- رائحة زنخة: عند تسخين بعض عينات حجر الجير القطراني.
ج- رائحة ثومية : وتصدر عن بعض المعادن الزرنيخية عند حكها أو تسخينها مثل معدن ارزنيوبايرايت.
د- رائحة كبريتية : عندما ينطلق غاز كبريتيد الهيدروجين بتسخين معدن البايرايت.
2- الملمس:
وهو التأثير الناتج عن لمس المعدن باليد، ويوصف المعدن بأنه ذو ملمس :
أ- بارد : وهو مميز للمعادن العنصرية مثل الذهب والنحاس.
ب- شحمي : وهو مميز لمعدن التلك.
ج- ناعم : وهو مميز لمعدن الأوبال.
3- الطعم :
تتميز بعض المعادن بطعم معين، وقد أمكن معرفة الأنواع الآتية :
أ- طعم قلوي.
ب- طعم ملحي.
ج- طعم مر.
د- طعم رطب.
ويميز كل طعم معدن معين، وهي صفة لا ينصح بالاعتماد عليها.
الخواص الضوئية للمعادن:
ويمكن تلخيص هذه الخواص بإيجاز في ما يلي:-
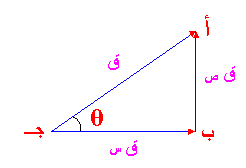
أ- معامل الانكسار: إذا سقط شعاع ضوئي على سطح معدن ما، فإن هذا الشعاع ينكسر عند نفاذه من العينة. فإذا كانت زاوية السقوط هي ق ، وزاوية الانكسار هي ك ، فإن معامل الانكسار يمكن كتابته بالشكل التالي:-
معامل الانكسار (م) = جا ق
جا ك
وتسمى هذه المعادلة قانون سنل.
ومعمل الانكسار يكون ثابتاً للمعدن الواحد مهما اختلفت زاوية السقوط، ويختلف هذا المعامل باختلاف المعادن، فمعامل الانكسار لمعدن الزركون يساوي 1,93 وتتراوح قيمة معامل الانكسار لمعدن الكوارتز من 1,553 إلى 1,544 أما معامل الانكسار لمعدن الفلورايت فيساوي 1,43 .
ب- الانكسار المزدوج:
وهو أن ينكسر الشعاع الساقط عند نفاذه من المعدن إلى شعاعين لكل منهما زاوية انكسار تختلف عن الأخرى، والمعادن التي لها خاصية كسر الشعاع الساقط إلى شعاعين منكسرين تسمى المعادن ذات الانكسار المزدوج. ومن أمثلة هذه المعادن، معدن الكالسايت ومعاملا الانكسار لهذا المعدن هما1,658 و 1,486 بفارق قدره 0,172 .
وتسمى المعادن التي يكون لها معامل انكسار ثابت مهما اختلف اتجاه سقوط الضوء، تسمى هذه المعادن متجانسة ضوئياً, والمعادن المتجانسة ضوئياً لا تفصل الشعاع الساقط إلى شعاعين، وإنما ينكسر الشعاع الساقط إلى شعاع واحد فقط.
التصنيف الكيميائي للمعادن:
يوجد المعدن على شكل مركب كيميائي يمكن بواسطة التحليل الكيميائي تحديد العناصر المكونة له وأيضاً معرفة معادلته الكيميائية وتوجد عدة طرق لتقسيم المعادن، بيد أن التصنيف الكيميائي يعد من أبسط وأشمل الطرق لتقسيم المعادن، وهو التصنيف المتبع في معظم جامعات ومتاحف الجيولوجيا في الوقت الحاضر. وتقسم المعادن من حيث تركيبها الكيميائي إلى عدة مجموعات كنا يلي:
1- مجموعة المعادن العنصرية : مثل الذهب والماس والكبريت.
2- مجموعة معادن الكبريتيدات : وهي المعادن التي يتحد فيها الكبريت مع العناصر الأخرى، مثل الجالينا والبايرايت.
3- مجموعة معادن الأكاسيد : وهي المعادن الناتجة عن اتحاد الكسجين بالعناصر الأخرى، مثل الكوارتز والهيماتايت والليمونايت.
4- مجموعة الهاليدات : وهي المعادن التي تتحد عناصرها مع عناصر الهالوجين (فلور, كلور, بروم, يود) مثل معدن الهالايت والفلورايت.
5- مجموعة معادن الفوسفات : وهي المعادن التي تتحد عناصرها مع مجموعة الفوسفات, مثل معدن الأباتايت.
6- مجموعة معادن الكربونات : وهي المعادن التي تتحد عناصرها مع مجموعة الكربونات، مثل الكالسايت والدولومايت.
7- مجموعة معادن الكبريتات : وهي المعادن التي تتحد عناصرها مع مجموعة الكبريتات مثل الانهيدرايت والجبس.
8- مجموعة معادن السيليكات : وهي المعادن التي تتكون نتيجة اتحاد مجموعة السيليكا مع عنصر أو أكثر. وتعد السيليكات من أكبر مجموعات المعادن, وتنقسم بدورها إلى عدة مجموعات أخرى, أهمها ما يلي:-
أ- الفلسبارات : ومنها الفلسبارات البوتاسية مثل الأرثوكليز ومنها الفلسبارات الصودية مثل الألبايت وكذلك الفلسبارات الكلسية مثل الأنورثايت.
ب- الأوليفينات : مثل معدن الأوليفين.
ج- البيروكسينات : مثل الأوجايت.
د- الأمفيبولات : مثل الهورنبلند




 الطب:
الطب: الصناعة:
الصناعة:



 eçon m’a aidé rapidement s’il vous plaît.
eçon m’a aidé rapidement s’il vous plaît.

 .
.



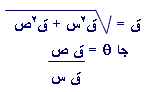
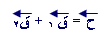
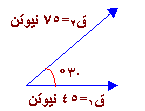
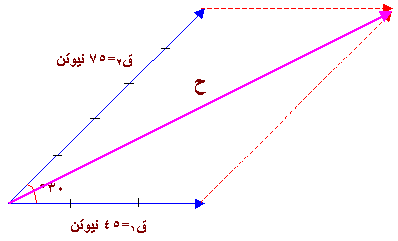
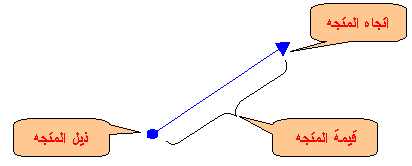
 ) يكون المتجه من ذيل المتجه الأول إلى رأس المتجهة الأخير .
) يكون المتجه من ذيل المتجه الأول إلى رأس المتجهة الأخير . 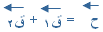
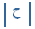 = 7.5 سم
= 7.5 سم
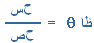
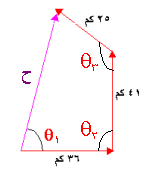 الحل :
الحل : 
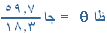
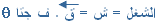
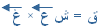
 = 5 × 5 = 25 نيوتن شرقاً
= 5 × 5 = 25 نيوتن شرقاً تقبلوا خالص تحياتي و إحترامي
تقبلوا خالص تحياتي و إحترامي